Atom Nedir? Atomları Nasıl Keşfettik? Maddenin Yapıtaşını Açıklayan Atom Teorisi, Zamanla Nasıl Evrimleşti?
Antik Yunan'dan Kuantuma, Atomların Doğasını ve Davranışlarını Nasıl Açıklıyoruz?
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fbdd7b84f0fbe77a2f9a7a00a7c211ff3.jpg) Atom Science
Atom Science
- Özgün
- Atomik Fizik
- Fizik Tarihi
:sharpen(0.5,0.5,true)/profile%2Ff3ac50f158c62b472760a4ac4ab37638.jpeg)
:sharpen(0.5,0.5,true)/profile%2F2aacbbe4-281f-4f73-9317-6cfea6fc8bc0.jpeg)
:sharpen(0.5,0.5,true)/profile%2F4903c2ab78d3d3165f076859fbc385c0.jpeg)
:sharpen(0.5,0.5,true)/profile%2Ffcae11ca334d20c09e80271fb26b69ec.jpeg)
:sharpen(0.5,0.5,true)/old%2Fprofile_images%2Fdf6a49f318627461a3e9b697f2a2984e.jpg)
:sharpen(0.5,0.5,true)/old%2Fprofile_images%2F6d2ea689090cbcbabe3eb1cec30c4d1c.jpg)
Bu Makalede Neler Öğreneceksiniz?
- Atom, maddelerin en küçük yapıtaşıdır ve çekirdek (proton ve nötronlar) ile etrafındaki elektronlardan oluşur; atom davranışlarını açıklamak için kuantum fiziği gereklidir.
- Antik Yunan filozofları Thales, Anaksimandros, Anaksimenes, Heraklitos ve Empedokles maddenin temel öğesi üzerine farklı teoriler geliştirmiş, ancak atom kavramını ilk sistematik olarak Demokritos ortaya koymuştur.
- John Dalton, 19. yüzyılda atom modelini bilimsel deneylerle destekleyerek kimyasal elementlerin atomlardan oluştuğunu ve atomların belirli kütle ve özelliklere sahip olduğunu kanıtlamış, böylece modern kimyanın temellerini atmıştır.
Atom, kimyasal bir elementi oluşturan maddenin en küçük yapıtaşıdır. Katı, sıvı, gaz ve plazma hâlindeki her madde, nötral veya iyonize olmuş atomlardan oluşur. Çoğu atom, 1 metrenin 10 milyarda biri (yani yaklaşık 100 pikometre) büyüklüğündedir. Bu kadar küçük ölçeklerde, kuantum mekaniğinden kaynaklı etkiler maddenin davranışını domine etmeye başlar. Bir diğer deyişle, örneğin bir tenis topunun davranışlarını kestirmekte kullandığımız klasik fizik, bu ölçekte anlamını yitirir. Dolayısıyla, atomlar kadar küçük nesnelerin davranışlarını açıklayabilmek için kuantum fiziği denilen özel bir fizik türünün kullanılması gerekir.
Her atom, bir çekirdek ve bu çekirdeğin etrafına bağlı hâlde bulunan 1 ya da daha fazla sayıda elektrondan oluşur. Atom çekirdeği ise 1 ya da daha fazla sayıda proton ve nötrondan oluşur. Hidrojen atomlarının en yaygın formu hariç, bütün atom çekirdeklerinde nötronlar bulunur. Elektronlar, proton ve nötronlara göre o kadar küçüktür ki, atomun toplam kütlesinin %99.94'ünü protonlar ve nötronlar tek başlarına oluştururlar.
Protonlar, pozitif elektrik yüküne sahiptir. Elektronlar, negatif elektrik yüküne sahiptir. Nötronlarsa elektriksel olarak yüksüzdür. Buna bağlı olarak, bir atomun çekirdeğindeki proton sayısı ile etrafındaki elektron sayısı birbirine birebir eşitse, o atom, elektriksel olarak yüksüz olacaktır. Eğer proton sayısı elektron sayısından fazlaysa o atom "pozitif", proton sayısı elektron sayısından azsa o atom "negatif" yüklü olacaktır. Bu şekilde pozitif veya negatif yüklü olan atomlara iyon denir.
Elektronlar, elektromanyetik kuvvet denilen bir kuvvet dolayısıyla çekirdekteki protonlara doğru çekilirler (bu kuvvetin onları neden çekirdeğe düşürmediğini buradan öğrenebilirsiniz). Çekirdekteki protonlar ve nötronları bir arada tutan kuvvet, güçlü nükleer kuvvet adı verilen bir kuvvettir. Bu kuvvet, ortalamada protonları birbirinden itmeye çalışan elektromanyetik kuvvete göre daha güçlüdür; bu nedenle atom kolay kolay parçalanmaz. Fakat belli şartlar sağlandığında, bu elektromanyetik kuvvet güçlü nükleer kuvvete baskın gelir ve atom parçalanarak, ardında orijinal elementten farklı elemente ait atomlar bırakır. Bu, çekirdek bozunması (nükleer füzyon) türlerinden biridir.
Atom içerisindeki protonların sayısı, atom numarası olarak bilinen bir sayı ile temsil edilir (bu numaraya anlam katan kişi, Çanakkale Savaşı sırasında hayatını kaybeden Henry Moseley'dir). Örneğin, çekirdeğinde 92 proton bulunduran her atom Uranyum atomu olmak zorundadır. Ancak bir atomun proton sayısı aynı olsa bile nötron sayısı farklı olabilir; bu tip atomlara izotop denir.
Atomlar, birbirlerine veya diğer atomlara kimyasal bağ denen bir elektromanyetik etkileşimle bağlanabilirler. Bu sayede üretilen daha iri birimlere molekül veya kristal gibi isimler verilir. Atomların birbiriyle bağ kurabilmesi ve bu bağların bozunması, Evren'de ve doğada gözlediğimiz fiziksel ve kimyasal değişimlerin neredeyse tamamının ana sebebidir. Atomun doğasını inceleyen bilim dalı genellikle fizik olsa da, atomların ve atomlar-arası etkileşimlerin değişimini inceleyen bilim dalı kimyadır. Elbette, fizik ve kimyanın sınırlarının birbirine girdiği fizikokimya gibi sahalar da bulunmaktadır.
Aydınlanma Öncesi Dönemde Atom Teorisi
Evrenimiz, 13,8 milyar yıl önce, Büyük Patlama (İng: "Big Bang") adını verdiğimiz kozmik bir olay sonucu oluştu. Bizim yuvamızın da içinde yer aldığı Güneş Sistemi 4,6 milyar yıl önce oluşmaya başladı. Yeryüzünün müreffeh sofrasında afiyetle yiyip içen ve onun içinde barındırdığı doğal zenginlikleri acımasızca katleden tek zeki yaşam formu insan, 2 milyon yıl önce gezegenin verimli topraklarında ve ferah yeşil çayırlarında yürümeye başladı. Milyonlarca yıllık bir süreç içersinde insanın yükselişi ile birlikte düşünceye dayalı bir sistem de gelişti: Bilim! Günümüzde Evren'e dair bildiğimiz her şeyi ona borçluyuz.
İnsanlık, düşünsel evrimini gerçekleştirdiği ilk zamanlardan beri maddeyle sürekli etkileşim halinde oldu. Zaman içerisinde maddeye şekil verdi ve kendi ihtiyacı doğrultusunda kullandı. Hiç kuşku yok ki uygarlık çevreyle kurulan uyumun sonucunda oluşturulabildi. İlk toplumların oluşmasıyla artan refah düzeyi ve kazanılan bilincin eşsiz bir getirisiyle insanlık, çevreye dair felsefi sorular sormaya başladı.
Yapısı gereği bilim ve antik çağlarda henüz bilimin ayrışmadığı haliyle felsefe, özgür düşünce ortamına muhtaçtır. Tarihimiz önemli bilimsel atılımlar gerçekleştiren toplumların daha sonra devamını sağlayamadıkları hoşgörü ortamlarının neticesinde yüzyıllarca aydınlanmanın gerisinde kalmalarına şahit olmuştur.
Bu doğrultuda, yazılı tarihimizin düşünce özgürlüğünü barındıran ilk toplumlarından birinin Antik Yunan toplumu olduğu söylenebilir. Bugün doğaya ilişkin zihnimizi dolduran nice bilgiler, bu toplumda yaşamış filozofların sordukları sorulara verilmiş nihai yanıtlardan oluşuyor. Bu anlamda bilimsel ilerleyişimiz, tarihin kaydettiği bütün aydın fikirli insanlarımızın omuzlarında yükselmiş katı bir bütünsellik arz etmekte.
Atomla tanışma maceramız da bilimin bu sistematik özelliğinden muaf olmayarak Antik Yunan'da sorgulayıcı bir zihin tarafından sorulmuş "ilk soru" ve ona sezgisel yolla verilmiş "ilk cevap"la başlıyor.
Evrim Ağacı'nın çalışmalarına Kreosus, Patreon veya YouTube üzerinden maddi destekte bulunarak hem Türkiye'de bilim anlatıcılığının gelişmesine katkı sağlayabilirsiniz, hem de site ve uygulamamızı reklamsız olarak deneyimleyebilirsiniz. Reklamsız deneyim, sitemizin/uygulamamızın çeşitli kısımlarda gösterilen Google reklamlarını ve destek çağrılarını görmediğiniz, %100 reklamsız ve çok daha temiz bir site deneyimi sunmaktadır.
KreosusKreosus'ta her 50₺'lik destek, 1 aylık reklamsız deneyime karşılık geliyor. Bu sayede, tek seferlik destekçilerimiz de, aylık destekçilerimiz de toplam destekleriyle doğru orantılı bir süre boyunca reklamsız deneyim elde edebiliyorlar.
Kreosus destekçilerimizin reklamsız deneyimi, destek olmaya başladıkları anda devreye girmektedir ve ek bir işleme gerek yoktur.
PatreonPatreon destekçilerimiz, destek miktarından bağımsız olarak, Evrim Ağacı'na destek oldukları süre boyunca reklamsız deneyime erişmeyi sürdürebiliyorlar.
Patreon destekçilerimizin Patreon ile ilişkili e-posta hesapları, Evrim Ağacı'ndaki üyelik e-postaları ile birebir aynı olmalıdır. Patreon destekçilerimizin reklamsız deneyiminin devreye girmesi 24 saat alabilmektedir.
YouTubeYouTube destekçilerimizin hepsi otomatik olarak reklamsız deneyime şimdilik erişemiyorlar ve şu anda, YouTube üzerinden her destek seviyesine reklamsız deneyim ayrıcalığını sunamamaktayız. YouTube Destek Sistemi üzerinde sunulan farklı seviyelerin açıklamalarını okuyarak, hangi ayrıcalıklara erişebileceğinizi öğrenebilirsiniz.
Eğer seçtiğiniz seviye reklamsız deneyim ayrıcalığı sunuyorsa, destek olduktan sonra YouTube tarafından gösterilecek olan bağlantıdaki formu doldurarak reklamsız deneyime erişebilirsiniz. YouTube destekçilerimizin reklamsız deneyiminin devreye girmesi, formu doldurduktan sonra 24-72 saat alabilmektedir.
Diğer PlatformlarBu 3 platform haricinde destek olan destekçilerimize ne yazık ki reklamsız deneyim ayrıcalığını sunamamaktayız. Destekleriniz sayesinde sistemlerimizi geliştirmeyi sürdürüyoruz ve umuyoruz bu ayrıcalıkları zamanla genişletebileceğiz.
Giriş yapmayı unutmayın!Reklamsız deneyim için, maddi desteğiniz ile ilişkilendirilmiş olan Evrim Ağacı hesabınıza üye girişi yapmanız gerekmektedir. Giriş yapmadığınız takdirde reklamları görmeye devam edeceksinizdir.
Evrenin yapısı hakkında düşünen ilk kişiler, günümüz Ege bölgesindeki Antik Yunan medeniyetine dayanır. İlk Yunan filozoflarından çoğunlukla doğa filozofları diye söz edilir. Çünkü bu düşünürler öncelikle doğayla ve doğal süreçlerle ilgilenmiştir (ve o dönemde henüz "bilim" diye bir uğraş bulunmamaktaydı). Atoma yönelik bir farkındalık, ilk kez bu bölge ve civarında zikredilmeye başlamış, yüzyıllar içinde doğruluğu kanıtlanarak günümüze kadar ulaşmıştır.
Thales ve "Arkhe"si
Antik Yunan toplumunun bu sorgulayıcı zihni, tarihimizin ilk filozoflarından olan ve felsefenin babası sayılan Thales’tir. Günümüze ulaşan hiçbir eseri bulunmayan ve düşüncelerini dönemin diğer yazarlarının yapıtlarından elde edebildiğimiz Thales'i binyıllara yayan ve onu insanlığın atomla tanışma serüveninin ilk adımına koyan özelliği birtakım şeyleri merak etmesiydi. Çevresinde neler olup bittiğini öğrenmek istiyordu ve maddeyi oluşturan "şey"in ne olduğu sorusunu sordu.
Ona göre bu şey, su olmalıydı. Kuşkusuz bu, sezgisel bir cevaptı; fakat gözlemsel boyutu da vardı: Thales, ezilen bazı şeylerden su çıktığını ve bitkilerin büyümesi için suya ihtiyaçları olduğunu gözlemleyerek bu yargıya varmıştı.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2F55cc6eab451c86b54e73fbbb785aa21c.jpg)
Başka bir söylenceye göre Thales, bu düşünceye dağların tepelerinde bulduğu bazı deniz canlısı fosiller aracılığıyla ulaşmıştı. Maddenin temel öğesinin su olduğunu düşünmesi, onu, dünyanın, denizde yüzen bir gemi gibi suyun üzerinde yüzdüğü görüşüne götürdü. Bu kadarla kalmadı ve depremlerin, Dünya'nın üzerinde yüzdüğü suda meydana gelen birtakım hareketlilikler neticesinde oluştuğunu savundu.
Thales'i dünyanın suda yüzdüğünü düşündüren şey ne olursa olsun onun getirdiği cevap doğal olanı açıklamak için doğaüstüne başvurmayıp yine doğal olan üzerinden gitmesiyle önem taşır ve bilimsel düşünceyi oluşturan ilk adım olarak görülür. Şaşırtıcı olan ve bilimi bu kadar güçlü kılan şudur ki; yazılı tarihimizde ilk olarak Thales'in sorduğu maddenin temel öğesi nedir sorusu bugün hala parçacık fizikçilerini yeni gizemlere götüren temel dürtüyü sağlıyor.
Aslında Thales'in düşüncesi "Her şeyin arkhesi sudur." şeklindeydi ve bu ifadede, doğaya dair önemli bir terim barınıyordu: Thales ve onun ardından bu soru üzerine kafa yoran dönemin diğer filozofları "Arkhe" sözcüğünü "temel" veya "ana madde" anlamlarında kullanmışlardı. Arkhe hakkında daha fazla bilgiyi buradaki yazımızdan alabilirsiniz.
Antik Yunan'da maddenin temel öğesine ilişkin kafa yoran yalnız Thales değildi. Thales'in öğrencisi Anaksimandros da son derece önemle karşılanacak bir cevap verdi.
Anaksimandros ve Apeiron
Anaksimandros’a göre "arkhe", apeiron'du. Eski Yunancada peiron, "sınırlı" anlamına gelir ve sözcüğün başındaki "a" eki olumsuzluk anlamı taşır: Yani apeiron, "sınırsız" demektir. Anaksimandros'u bu düşünceye iten, Thales'in arkhesi olan suyu yetersiz bulmasıydı. Ona göre maddenin temel öğesi somut olarak belirlenemezdi ve Dünya'da gözlenememesi gerekliydi.
Anaksimandros, apeiron kavramını oluşturarak zıtların birleşimine vurgu yapıyordu: Ateş ve su gibi çiftlerin birbirini yok etmesiyle, apeiron oluşuyordu. Dolayısıyla her şeyin başında bütün maddeler zıtlığın güdümüyle apeirondan meydana gelmişti. Bu önermeyle birlikte bütün maddelerin bir zıttı olduğu fikri ortaya çıkıyordu ve bu, bugün itibariyle bize oldukça tanıdık geliyor.
Anaksimandros, madde ile karşı madde birleşince ortaya saf enerji çıkması gerçekliğini ilkel düzeyde de olsa açıklayarak düşünsel bir zirveye oturmuştur. Onun bu görüşü zamanının haylice ilerisindeydi ve çağdaşları tarafından anlaşılmaktan uzaktı. Nitekim takipçisi sayılabilecek Anaksimenes, Thales’in yorumuyla benzer nitelikte arkhe’yi somut olarak belirtti ve onun hava olduğunu söyledi.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5026_62_anaximander_by_artofty.jpg)
Anaksimenes ve Hava
Anaksimenes'inse arkhe olarak neden havayı tercih ettiği anlaşılabilir: Hava, suya oranla yaşamsal anlamda daha büyük bir zorunluluk teşkil eder. Hava sıkışıp gevşeyebilen bir şeydir ve bu şekilde suyu ve ateşi meydana getirebilir. Sonrasında su da sıkışarak toprağı ve nihayetinde taşı meydana getirebilir. Anaksimenes arkheyi hava olarak belirlerken neyi düşünmüş olursa olsun bilimsel argümanların yeni yeni filizlendiği coğrafyada önemli bir düşünür ve sorgulayıcı olmuştur.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5027_62_anaximenes-lxviiiv.jpg)
Heraklitos ve Ateş
Antik Yunan felsefesinde çok önemli bir yeri olan Heraklitos da bu konuyla ilgili görüş bildirmekten uzak durmadı. Ona göre de her şey ateşten meydana geliyordu. Dünyamız ve tüm evren sonsuz olarak yanan bir ateşten oluşmuş ve bir vakit sonra her şey tekrar ateşe dönüşecekti.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5028_62_hendrik_ter_brugghen_-_heraclitus.jpg)
Empedokles ve 4 Temel Öğe
Daha sonrasındaysa sahneye Empedokles çıktı. O, temel öğe olarak tek bir nesne belirlemedi; kendinden öncekilerden de yola çıkarak sayıyı dörde çıkardı. Ona göre doğanın temel dört öğesi vardı ve bütün maddeler bu dört öğenin çeşitli birleşimlerinden meydana gelmişti. Hepimizin aşina olduğu şekilde bu dört temel öğe; ateş, su, hava ve topraktı.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fpublic%2Fimages%2Fdyn%2F079d4caaeb1befa401708a0f994f0d39.png)
Empedokles'e göre bu dört temel öğe, Evren'in başlangıcından beri vardır ve miktarı hiç değişmemiştir. Diğer tüm maddeler, bunlar arasındaki birleşimlerden meydana gelmiştir. İlk birleşme, "çatışma" olarak tanımladığı su ve ateş arasında meydana gelmişti. İkinci birleşmeyse toprak ve su arasında gerçekleşmiş ve Empedokles bunu "sevgi" olarak tanımlamıştı. Getirdiği önemli bir yorum ise, diğer tüm maddelerin bu birleşmelerin farklı oranlarda gerçekleşmesiyle oluştuğu düşüncesidir. Empedokles, bu düşüncesiyle elementlerin farklı oranlarda bir araya gelerek farklı bileşikler oluşturduğu günümüz gerçekliğine önemli bir yaklaşım sergilemiştir.
Empedokles'in ortaya attığı fikir, dönemi açısından değerlendirildiğinde kayda değerdi; fakat önemli bir simetri sorunu vardı: Bu simetri sorunu, tarif ettiği birleşmelerde değil, bütünlükte bazı sorunlar çıkarıyordu. Empedokles'in dört arkhesi olan toprak, su, ateş ve havayı karıştırınca, onun tarifleriyle ilgisi olmayan bir bütünleşme meydana geliyordu. Maddeyi oluşturan temel öğelerden bahsederken birleşmeleri bütünlükte de görebilmek teoriyi daha da güçlendirebilirdi.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5029_62_empedocles.jpg)
Henüz hiçbiri günümüzde temel aldığımız önermeyi oluşturamamış olsa da bu antik Yunan filozofları bilimsel ilerleyişin önemli bir taşıyıcısı olmuşlardır. Nihayetinde soruyu soran onlardır; fakat bazı durumlarda, daha sağlıklı cevaplar edinebilmek adına elinizde bulundurduğunuz soruyu önemli gözlemsel sonuçları doğurabilecek ikinci bir soruyla desteklemek faydalı olabilir. İkinci soruyu ilk kimin sorduğunu bilemeyiz; fakat kimin bu sorunun ne derece üstüne gittiğini anlayabiliriz; çünkü bu sorunun üstüne gitmek sorgulayıcı bir zihni kaçınılmaz olarak bir bilimsel devrime götürecektir.
Maddenin temel öğesini ararken soracağımız soru basittir. Herhangi bir cismi parçalarına ayırabiliriz. Parçalardan herhangi birini alıp tekrar parçalarına ayırabiliriz. Belki bir kez daha aynısını yapabiliriz. Peki, bu işlemi nereye kadar sürdürmek mümkündür?
Demokritos ve Atom: Maddeyi Anlamada Devrim!
Leukippus: Doğayı Doğayla Açıklamak...
Evren'deki her şeyin atom (Yunanca atomos, yani bölünemeyen anlamı taşır) adı verilen, gözle görülemeyen küçücük parçacıklardan olduğu görüşü ile birlikte Atom Krallığı’nın temelleri M.Ö. 5. Yüzyılda Yunanlı doğa filozofu Miletli Leukippus ve öğrencisi Abderalı Demokritos'a dayanır.
O dönemlerde uygarlıkların çevresinde gelişen ilginç olayları açıklamada doğaüstü güçlere başvuruluyordu. Leukippos, her olayın doğal bir nedeni olduğunu sistematik bir şekilde ilk kez dile getirip, doğal olaylara yönelik olarak geliştirilen doğaüstü açıklamaları elinin tersiyle bir yana iterek, günümüzün bilimsel görüşünü kendi zamanında temsil etti. Ayrıca onun Evren'e dair fikirleri, öğrencisi Demokritos'un fikirleriyle birebir örtüşmekteydi.
Abderalı Demokritos ve Atom Fikrinin Doğuşu
Leukippus'un öğrencisi Abderalı Demokritos'un, yaklaşık olarak M.Ö 460-370 yılları arasında yaşadığı tahmin edilmektedir. Demokritos, zamanındaki pek çok kişiye nazaran çok seyahat etmiş birisidir; Babil'den Mısır'a ve oradan da Hindistan'a uzanan bir yolculuk hikâyesi vardır. Gezilerinin amacı, bilim ve sanatın kalbinin attığı yerlerde bulunarak, oradaki yeni fikirleri anlayıp kavramak ve kendi düşüncesine göre şekillendirmekti; zira onun bu kadar seyahat etmesinin nedeni bilgi arayışıydı. O, bir bilgi avcısıydı; nitekim sırf matematik eğitimi almak için Mısır'a gitmesi bunun apaçık delilidir.
Demokritos'u bilimsel anlamda devrimci yapan şey, atomun parçalanabilirliğine yönelik sorunun üstüne gitmesi ve bugün bildiğimiz kadarıyla doğru bir yaklaşım sergileyebilmesiydi. Demokritos öncesinde maddenin temel öğesini arayan filozoflar, parçalama işlemini sonsuza kadar yapabileceklerini düşünmüşlerdi. Çünkü onların madde anlayışı sürekliydi. Oysa Demokritos'a göre parçalama işleminin son bulacağı bir nihai öğe olmalıydı. Daha küçük parçalara ayrılamayacak olan bir nihai parça... Demokritos bu temel öğeye "bölünemeyen" anlamına gelen “atomos”, yani "atom" ismini verdi.
Demokritos'a göre tüm maddeler, görülemeyecek denli küçük olan atomlardan oluşmuştur ve atomlar daha küçük parçalara bölünemezler. Bir madde sonsuza dek bölünemezdi; çünkü böyle bir şey mümkün olsaydı, çevremizde gördüğümüz maddelerin hiçbirinin var olmaması gerekirdi. Oysaki bir maddeyi yalnızca daha küçük parçalarına ayırabilirdiniz ve bu işlem süreklilik içinde aynı işi defalarca tekrar etmenize neden olurdu; netice itibariyle her elde ettiğiniz küçük parçacık bir önceki parçanın daha da küçük, temel bir parçasıydı. Kısacası, Demokritos'a göre maddeyi tamamı ile ortadan kaldıramazsınız ve elinizde her zaman kalan parça, atomdur. Ayrıca yine Demokritos'a göre, maddeyi oluşturan atomlar arasında boşluklar vardır. Bu boşluklar sayesinde, atomlar doğada hareket edebilirler.
Yunanlı doğa filozofunun değindiği en önemli noktalardan biriyse, atomların belirli boyutları, biçimleri ve ağırlıklarının var olması gerektiğini dile getirmesiydi. Ona göre doğadaki çeşitlilik, bu maddeler sayesinde oluşabiliyordu. Günümüzde modern kimya ve fizik bilimlerinden elde ettiğimiz bilgiler ışığında Demokritos'un bu görüşü doğrudur!
Abderalı filozofun doğanın atomlardan oluşmasına yönelik bir diğer ilginç fikri de, eskiden "ruh" olarak tanımlanan kavramın da atomlardan oluştuğunu ileri sürmesidi. Ancak ona göre ruhu meydana getiren atomlar, doğal çevremizdeki nesnelerden daha ince, hafif ve hareketlidir. Günümüzde "ruh" kavramının bilinçle ilişkili olduğunu biliyoruz; ancak bu tanımı dolayısıyla Demokritos'u, tarihin en eski materyalist filozofları arasında saymak mümkündür.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5030_62_hendrik_ter_brugghen_-_democritus.jpg)
Karanlığa Gömülüş ve Orta Çağ'daki Duraklama
Demokritos ile birlikte Antik Yunan döneminde zirveye oturan maddenin temel öğesine yönelik kavrayış, daha sonrasında tamamıyla terk edildi. Platon ve Aristo'yla birlikte materyalist düşünce yerini idealizme bıraktı. Bu nedenle bilimsel ilerlemeyi kamçılayan gözlemsel araçlara başvurma ihtiyacı önemini yitirdi. Atomları gözlemek veya teoriyi sınamak adına hiçbir şey yapılmadı.
Antik Yunan'dan sonra birtakım hurafelerin benimsendiği dönemde hoşgörü ve özgür düşünce terk edildi. Avrupa, Orta Çağ karanlığına gömülürken, İslam dünyası bilimi devraldı. Önemli atılımlar gerçekleşti; ancak maddenin temel öğesiyle ilgili atom teorisini sınamaya veya geliştirmeye yönelik kayda değer bir çalışma orada da yapılmadı.
Böylelikle Demokritos'un ortaya attığı atom fikri, sınanmak ve geliştirilmek için yüzyıllarca bekledi. Dinler, imparatorluklar, savaşlar, kıyımlar arasında geçen zaman, insanlığa acıdan başka bir şey vermemişti. İslam dünyası ilk birkaç yüzyılından sonra bilimsel atılımlarına yavaş yavaş son verirken, Avrupa toplumu karanlığın içinden zorlu da olsa sıyrılıyordu.
Bilimsel Aydınlanma ve Bilimin Yeniden Doğuşu
14. yüzyıla gelindiğinde Rönesans hareketiyle birlikte bilimsel bir devrim yaşanmaya başladı. İstanbul'un fethedilmesinden bir yıl sonra, 1454'te Gutenberg'in matbaa makinesi bu devrimin öncüsü oldu. Fetihten doksan yıl sonra, 1543'de Nikolaj Kopernik'in Gökcisimlerinin Devinimi Üzerine adlı kitabıyla Avrupa, bilimsel anlamda aydınlanmaya adım attı. 1572'de Tycho Brahe'nin gökyüzündeki yeni bir yıldızı eserlerinde bildirmesi, gökyüzünün sabit olduğu düşüncesine karşı büyük bir kuşku uyandırdı. 1609'da Johannes Kepler, gezegenlerin yörüngelerinin elips şeklinde olduğunu açıklaması bazı kesimler üzerinde şok etkisi yarattı. Aynı yıl içerisinde Galileo Galilei, icat ettiği teleskopla gökyüzünü seyre daldı. Sonrasında İngiliz fizikçi Isaac Newton'un çalışmaları ve Philosophia Naturalis Principia Mathematica adlı eseri bilimi pek çok yönden temellerine oturttu.
17. yüzyılla birlikte birçok değerli aydının önderliğinde başlayan düşünsel bir hareketle, deyim yerindeyse Avrupa, kabuklarını sonunda kırmıştı. Yeni yeni filizlenen düşünce özgürlüğü ortamında yine bildik sorgulayıcı zihinler çokça zamandır duraksamış olan bilimsel ilerleyişi devraldılar.
Atom teorisinin Zümrüdüanka misali küllerinden yeniden doğması, 1662’de İrlandalı Kimyager Robert Boyle'un havanın sıkıştırılabileceğini (Boyle Yasası) keşfetmesiyle yeniden gündeme geldiyse de zamanla tekrardan unutulup gitti.
Atom teorilerinin gelişimi için kabuğunu kırmakta olan Avrupa'da ilk kalıcı adım Antoine-Laurent Lavoisier tarafından atıldı. Fransa’da varlıklı bir ailenin çocuğu olarak dünyaya gelen Lavoisier, kendi imkânlarıyla bir laboratuvar kurdu ve burada önemli deneyler gerçekleştirdi. Aslında o dönemde onun gibi kimyayla ilgili çalışmalar yapan başka insanlar da vardı; fakat onu önemli kılan, uyguladığı deneylerinin sonuçlarını bir teoriye oturtabilmesiydi.
Bu anlamda çeşitli gazları elde etmeyi başaran Cavendish ve Priestley, hidrojen ve oksijenin birleşerek su oluşturduğunu 1781’de gözlemlediler. Daha sonra bu deney çalışmalarını öğrenen Lavoisier deneyleri tekrarladı ve sonuçlarını 1783'te Bilim Akademisi'ne sundu. Lavoisier'in deney sonuçları hayli sarsıcıydı; çünkü o dönemde hala Empedokles'in dört temel elementi kabul görüyordu. İki ayrı gazın kapalı bir kap içerisinde birleşerek su oluşturması suyun temel öğe olmadığı anlamına geliyordu. Bu durumda ya bu dört temel öğenin içinden su çıkartılacak ya da bu fikir topyekûn terk edilecekti.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5031_62_portrait_of_antoine-laurent_lavoisier_and_his_wife.jpg)
Henüz ortada Demokritos'un unutulmuş atomlarını tartışan kimse yoktu. Eldeki deliller de bunu göstermek için yetersizdi. Atomlardan habersiz Lavoisier, 1787'de klasik çalışması Méthode de Nomenclature Chimique'te kütlenin korunumu yasasını açıklayarak kimyanın babası unvanını aldı.
Bu aşamada Joseph Proust çalışmaları ilerletti. 1799 yılında, kapalı kapta su oluşurken hidrojen ve oksijenin yalnız belli oranlarda birleştiklerini fark etti. Örneğin 18 gram suyu oluşturmak için 16 gram oksijen ve 2 gram hidrojen gerekiyordu. Kaba daha fazla oksijen veya hidrojen gönderilmiş olsa dahi, fazla olan kısım suyun oluşumuna hiçbir katkı sağlamıyordu. Proust, önemli bir yasayı keşfetmişti ve buna "sabit oranlar yasası" denildi.
John Dalton: Sistematik İlk Atom Modeli
Atom düşüncesine giden yolda sistemli bir model oluşturan ilk kişi John Dalton oldu. Dalton, Proust’un yasası üzerine çalışırken bir sorunla karşılaştı: Zaman zaman iki elementin birleşiminde farklı bileşikler ortaya çıkabiliyordu. Örneğin karbon ve oksijen üzerine çalıştığında kimi zaman çok zehirli olan karbonmonoksit, kimi zamansa yaşamsal olarak ihtiyaç duyduğumuz karbondioksit oluşuyordu. Bu çelişkinin üzerine gitmeyi denedi ve deneyini her tekrarladığında, kaba gönderdiği karbon ve oksijenden birini sabit tutarak diğerini kontrollü olarak arttırdı. Çok geçmeden önemli bir yasa keşfettiğini fark etti ve 1804 yılında "katlı oranlar yasası" doğmuş oldu. Yasayı anlamak adına örnek vermek gerekirse: Karbondioksitin 44 gramında 12 gram karbon 32 gram oksijen, karbonmonoksidin 28 gramında ise 12 gram karbon 16 gram oksijen vardır. Bu doğrultuda her iki bileşikte de 12 gram karbona karşılık karbondioksitte 32 gram oksijen karbonmonoksitte 16 gram oksijen olmuş olur. İki bileşikteki oksijen kütleleri arasında 32/16=2 olmak üzere, katlı bir oran vardır.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5032_62_john_dalton_by_charles_turner.jpg)
Dalton, Proust’un yasasının üzerine yeni bir yasa keşfedince, maddenin doğası üzerine düşünmeye koyuldu. Elementlerin birbirleriyle belli oranlarda birleşmesi, maddenin temelinde bölünemeyen parçacıklara, yani atomlara işaret ediyordu. Elementler arasındaki bu "basit, sabit, tam sayılar", aslında atomların oranıydı.
Dalton Atom Modeli Nedir? Özellikleri Nelerdir?
Dalton, bu düşüncesinde son derece haklıydı ve bu doğrultuda 1805 yılında ilk atom modelini geliştirdi:
- Bütün maddeler atom adı verilen çok küçük parçalardan oluşur ve bu atomlar bölünemez, var edilemez ve yok edilemezdir.
- Bir elementin bütün atomları şekil, kütle ve hacim gibi özellikleri bakımından birbirinin aynı olmakla birlikte diğer elementlerin atomlarından farklıdır.
- Kimyasal reaksiyonlar farklı element atomlarının birleşmesinden ibarettir. Bu atomlar birbirleri ile basit ve tam sayılarla ifade edilebilecek oranlarla birleşirler.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5033_62_1803_dalton2.jpg)
Dalton, bu kadarla yetinmeyerek 1808'de yayımladığı Yeni Kimya Felsefesi Sistemi isimli kitabında, atom fikrini biraz daha ileriye taşıdı. Deneylerinde elde ettiği bileşiklerinin kütle oranlarını birbirleriyle karşılaştırarak birtakım basit matematiksel oran uğraşı sonucunda en hafif atomun hidrojen olduğunu saptadı. Suyun oluşumunun iki hidrojen atomunun bir oksijen atomuyla birleşerek gerçekleştiğini gördü. Bir element listesi hazırladı ve atom ağırlıklarını hidrojenin katları cinsinden belirtti. Bu özelliğiyle Dalton'un çalışması, her ne kadar verdiği ölçüler yüzde yüz doğru olmasa da günümüzdeki periyodik cetvelin temelini oluşturdu.
1811’de İtalyan fizikçi Amedeo Avagadro, kendi adıyla anılan bir hipotez geliştirdi. Buna göre aynı hacme, basınca ve sıcaklığa sahip tüm gazların aynı sayıda parçacıktan oluştuğunu ileri sürdü. Ayrıca bileşimleri oluşturan tek atomlarla çok farklı atomların bir araya gelmesiyle oluşan yapıya Latince "küçük kütleler" anlamındaki sözcüklerden moleküller adını verdi. 1815 yılında İngiliz kimyager William Prout, maddelerin yapıtaşını bulduğunu sandı. Ona göre hidrojen temel atomdu ve diğer bütün atomlar farklı sayıda hidrojen atomlarından oluşmuştu. Bilim tarihinde Prout Hipotezi olarak bilinen bu görüş yanlış kabul edildi ve dikkate alınmadı.
Dalton Sayesinde İlk Periyodik Cetvelin Geliştirilmesi
Fikirsel temeli çok eskilere dayanmış olmasına karşın, atom kavramını bir hayli dolaylı olan yöntemlerin neticesinde ortaya koyabilmiş olması, Dalton'a üstün bir hayalgücü ve kavrayış yüklüyor. Onun bu üstün niteliklerine rağmen, her bilimsel atılım gibi atom fikri de bir takım dirençle karşılaştı. Üstelik bu dirençler, yine bilim camiasından geldi: Birçok filozof ve bilim insanı, tespit edilemez ve bölünemez parçacıkların varlığını kabullenmek istemiyordu. Dönemin ünlü filozofu Willam Whewell, 1840'ta yayımlanan Philosophy of the Inductive Science adlı çalışmasında şöyle diyordu:
Ama eğer atomik kuram öne sürülecekse (ki buna göre kimyasal elementler bölünemeyen parçacıklardan oluşmaktadır), şunu belirtmeden geçemeyiz ki, kimyasal araştırma bunu kanıtlamamıştır ve hatta hiçbir doyurucu kanıt ortaya koyamamıştır.
Atom görüşünü benimsemeye yanaşmayan kimyacılarsa, atom fikrinin kimyasal birleşimleri açıklamakta yalnızca basit bir kolaylık sağladığı, fiziksel gerçekliğinin olmadığı görüşündeydiler. Nitekim 1867'de ünlü kimyacı Friedrich August Kekule de atom fikrini benimsemekten uzaktı:
Atomların var olup olmadığı sorusu kimyasal bakış açısıyla hiçbir önem taşımamaktadır; bu tartışma, metafiziğe ait bir tartışmadır.
Tüm bu olumsuz fikirlere rağmen atom düşüncesi üzerinde çalışılmaya değerdi. Bilim insanları sürekli devam ettirdikleri deneylerinde yeni kimyasal atom türleri keşfediyordu. Günden güne kabaran liste, doğanın zarafetine gölge düşürmek istercesine kabarıklaşıyordu. Acaba bütün bu elementleri birbirine bağlayan basit ve tekrarlanan bir uyum var mıydı? Giderek büyüyen element listesi nasıl sadeleştirilerek bir sisteme oturtulabilecekti?
Bu defa bilimsel sıçrayış, sorgulayıcı bir zihnin dahiyâne fikirlerinden değil yalnızca düzenli bir sistem kurabilme çabasının sonucu olarak gerçekleşti. Bu uğurda bir endüstri kimyacısı olan John Alexander Newlands 1864'te atom ağırlıklarına göre sıraladığı atomların ilk 8'inden sonra benzer fiziksel ve kimyasal özelliklerin tekrar ettiğini keşfetti ve bir tablo hazırladı.
Newlands ilk periyodik tabloyu hazırlayan kişi olsa da onu geliştirenler Julius Lother Mayer ve Dimitri Mendeleyev oldu. Mayer ve Mendeleyev benzer sonuçlara gitmelerine karşın, Mendeleyev henüz bulunmamış elementleri öngörmesi nedeniyle periyodik tablonun babası kabul edilir. Mendeleyev'in 1869'da oluşturduğu tabloda henüz keşfedilmemiş olduğunu düşünerek boş bıraktığı yerler birkaç yıl içinde onun öngördüğü şekilde dolduruldu. Bunda, Çanakkale Savaşı'nda hayatını yitiren Henry Moseley'in çalışmaları büyük rol oynamıştır.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5034_62_draft.jpg)
Kimyacılara Güç Katan Dehalar: Fizikçilerin Konuya Dahil Oluşu
Periyodik tablonun oluşumuna kadar atom düşüncesiyle uğraşanlar çoğunlukla kimyacılar olmuştu. Maddenin doğasını, maddeler arasındaki ilişkileri araştırıyor olmaları onları doğrudan atoma götürmüştü. Buraya kadar bilim insanlarının zihninde, atomun yapısına dair bilgiler içeren herhangi bir resim yoktu. Fakat diğer taraftan onyıllardır doğanın temel bir kuvvetini; elektriği anlamaya çalışan fizikçilerin yolları da atoma dair yapılacak keşiflere doğru gidiyordu.
Elektriği anlamaya çalışan fizikçiler kendilerine iyi düşünülmüş ve biraz da eğlenceli bir deney aleti geliştirdiler. William Crookes tarafından geliştirildiğinden Crookes Tüpü olarak bilinen bu alet, havası boşaltılmış uzun cam bir tüpün içine istenilen gazın düşük basınçta verilmesi ve tüpün iki ucuna yüksek gerilim uygulanmasıyla elde ediliyordu. Tüplü televizyonların çalışma mantığını içeren ve günümüzde kendine ancak laboratuvarlarda yer bulabilen bu alette, uygulanan yüksek gerilim nedeniyle eksi uçtan (katottan) artı uca doğru (anoda) giden ışınlar görülür. Bu ışınlara katot ışınları denir ve bu doğrultuda Crookes Tüpü, zaman zaman katot ışınları tüpü olarak da adlandırılır. Modern televizyonlara giden yol, katot ışın tüpleri sayesinde mümkün olmuştur. Ancak katot ışınlarının doğasını anlamak üzere yapılacak çalışmalar, "bölünemez" zannedilen atom fikrini kökünden sarsacaktı.
Thomson Atom Modeli ve Elektronun Keşfi
1897'de katot ışınlarının doğasını anlamaya çalışan bir fizikçi atoma dair önemli bir keşfe imza attı. İngiliz fizikçi Joseph John Thomson laboratuvarında bir katot ışın tüpü oluşturdu ve beklediği üzere, katottan çıkan ışınlar anoda doğru yöneliyorlardı. Thomson, bu ışınları biraz incelemek istedi ve anotta küçük bir delik açarak karşısına floresan bir ekran koydu. Floresan ekrana çarpan katot ışınları, ekranda küçük noktaların parlamasına neden oluyordu. Bu doğrultuda ışınların parçacıklı yapıda olduklarını anladı.
Parçacıkların bir elektrik yüke sahip olup olmadığını ortaya çıkarmak için yolları üzerine birbirine paralel iki adet metal levha yerleştirerek ikinci bir pille levhaları zıt olarak yükledi. Böylelikle levhalar arasında bir elektrik alan yaratmış oldu ve eğer katottan çıkıp anota giden ışınlar bir elektrik yüküne sahiplerse yollarının sapması gerekecekti. Deneyini gerçekleştirdiğinde katot ışınlarının yollarının saptığını gördü ve sapma artı yüklü levha yönünde oluyordu. Zıt yükler birbirini çekeceğinden katot ışınlarını meydana getiren parçacıkların eksi yüklü olduğu anlaşılıyordu.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5035_62_jj-thomson2.jpg)
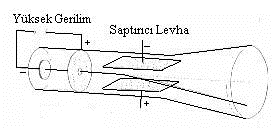
Thomson, katot ışınlarının elektrik yüklü olduğunu görmüştü; fakat ona dair daha temel özelliklere sahip olabilmesi için biraz daha bilgiye gereksinim duyuyordu. Amacı, parçacığın karakteristik özelliklerini belirleyebilmekti ve hız bilgisi işine yarayabilirdi. Bu doğrultuda, katottan çıkan ve elektriksel alan dolayısıyla yolundan sapan parçacığın, sapmasına engel olacak ölçüde etkiyecek şekilde bir manyetik alan oluşturdu. Böylelikle parçacık, sanki hiçbir etki altında değilmiş gibi doğrusal olarak gidecekti. Zıt yönde oldukları için parçacığı yolundan saptırmayan elektrik ve manyetik kuvvetlerin büyüklüğünü kullanarak enerji denkliği sayesinde hız bilgisini elde edebilecekti. Daha sonrasında ise kuvvetlerin denkliğiyle de parçacığın yük/kütle değerine ulaşacaktı.
Hesabı ve düşüncesi tamamıyla doğruydu. Bulduğu değer de beklediğine oldukça yakındı; ama bir türlü tam değeri elde edemiyordu. Deneyini farklı şartlar altında özellikle de katot malzemesini ve tüpün içindeki gazı değiştirerek de defalarca tekrarladı fakat sonuç hiç değişmedi. Her seferinde aynı yük/kütle değerine ulaşıyordu. Bu eksi yüklü parçacık, malzeme ne olursa olsun değişmediğine göre temel bir parçacıktı ve Thomson ona "elektron" ismini vermeyi uygun gördü.
Thomson'ın bu deneyi ve sonrasındaki temel fizik hesabı atom düşüncesinin önemli bir adımı olarak görülür. Çünkü sonucunda yeni bir atom modeli oluşabilmiştir. Thomson, elektronu keşfetti ve bu keşif elbette Dalton'un bölünemez atomlarına ağır bir darbe vurdu. Deneyde kullandığı malzeme ne olursa olsun sonuç değişmediğinden, Dalton'un savunduğu şekilde her elementin atomları birbirinden tamamıyla farklı olmamalıydı. Her atomda, keşfettiği elektron kendine yer bulabilmeli ve bu elektron, atomunu terk edip tüpün içinde gezebildiğinden, atomun bölünemezliği düşüncesi terk edilmeliydi.
Öte yandan elektron, eksi yüklü bir parçacıktı; fakat atomlar yüksüzdü. Öyleyse atomun içinde bu yük dengesini sağlayacak artı yükler olmalıydı. Diğer bir tespitse, elektronun yük/kütle oranının çok yüksek olmasıydı. Bu elektronun kütlece çok küçük olduğu anlamına geliyordu.
Thomson Atom Modeli Nedir? Üzümlü Kek Modeli Ne İşe Yarar?
Bütün bu bilgiler ışığında Thomson yeni bir atom modeli oluşturdu ve modelinde atomun artı yükten oluştuğunu içinde eksi yüklü gömülü elektronlar barındırdığını söyledi:
- Atom, artı yüklü maddeden oluşmuştur.
- Elektronlar, bu artı madde içinde gömülüdür ve hareket etmezler.
- Elektronların kütleleri çok küçüktür; bu yüzden atomun tüm kütlesini artı yüklü madde oluşturur.
- Atom, küre şeklindedir.
:sharpen(0.5,0.5,true)/evrimagaci.org%2Fdosyalar%2Ffotograflar%2Fozgun%2F62%2F5037_62_slide0006_image006.jpg)
Thomson'ın atom modeli, elektronları hareketsiz ve atomun içerisinde homojen biçimde dağılmış olarak aldığından, üzümlü kek modeli olarak da bilinir. Onun oluşturduğu atom modeli, günümüzde bildiklerimize nazaran oldukça farklı bir yapı çizer. Modelin elbette birçok hatası vardır; fakat atomun yapısını ortaya çıkarmaya dair kayda değer bir ilerleme sağlamıştır.
Rutherford Atom Modeli ve Çekirdeğin Keşfi
19. yüzyılın sonlarında fizikçiler, birkaç küçük detayın ötesinde bilinmeyenlerin kalmadığı, fiziğin sonuna gelindiği gibi bilimin karakteriyle uyuşmayan bir düşünceye kapıldılar. Aslında bunda kısmen haklı da olabilirlerdi. Galilei ve Newton'un mekanik alanındaki araştırmalarıyla başlayan bilimsel ilerleyiş süreci, yaklaşık üç yüz sene öylesine yoğun geçmişti ki, bilim insanları bile ortaya çıkan gerçekliklerin haricinde doğanın herhangi bir saklı yüzünün kalmadığını düşünmekte haklıydılar.
Fakat elbette, işin aslı böyle değildi. Bunun böyle olmadığını gösterecek kişilerden biri de Cambridge'te Thomson'ın Cavendish Laboratuvarı'nda doktora öğrencisi ve asistanı olarak çalışan Ernest Rutherford idi. Rutherford, Thomson'ı elektronun keşfine götüren çalışmaları sırasında onun yanında bulunmuş, yardımcısı olarak çalışmıştı. Şimdi, hocasından aldığı bilim meşalesini daha ilerilere taşıyacaktı.
Yüzyılın sonunda Marie Curie ve Pierre Curie, uranyum ve toryum elementleri üzerinde çalışmaya başladılar ve kısa zamanda bu elementlerin fiziğe yeni bir bakış açısı getirmeye gebe olduklarını anladılar. Uranyum ve toryumun kendiliğinden bozunma özelliği gösterdiklerini keşfettiler ve bu olaya "rakyoaktivite" ismini verdiler. Daha sonrasında polonyum ve radyumun da böyle bir özelliği olduğunu gözlemlediler. Radyoaktivite atomun keşfi sürecinde fizikçilerin çok işine yarayacaktı.
Bu anlamda Rutherford, fiziğin yeni alanıyla ilgilenmeye başladı. Rakyoaktivite özelliği gösteren rakyoaktif atomların bozunma süreci birtakım ışımalar yaparak gerçekleşiyordu. Rutherford, bu ışımaları kategorize etti: Işınları bir manyetik alanın içerisine gönderdiğinde kimisinin katot ışınlarıyla (elektronlarla) aynı yönde kimisininse ters yönde saptığını gözlemledi. Ters yönde sapma gösteren ışımaların elektrik yüklerinin katot ışınlarıyla zıt olması gerekirdi ve bu ışımaya alfa ismini verdi. Aynı yönde sapanlara ise beta dedi. Bir de manyetik alandan hiç etkilenmeyen ışıma türü vardı. Bunun yüksüz olacağını düşündü ve gama ismini uygun gördü.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2F38658b221e5f78193e25eabb737f2302.jpg)
Rutherford, radyoaktivitenin sırlarını keşfetmeye çalışırken atomun yapısıyla ilgili ciddiye alınması gereken bir önerme geldi. 1903 yılında Japon fizikçi Hantaro Nagaoka, "Satürn Modeli" dediği bir atom tarifi yaptı. Ona göre elektronlar artı yüklü bir parçacık etrafında aynı düzlem üzerindeki dairesel yörüngelerde dolaşıyorlardı. Onun modeli ne derece kayda değer bulundu bilinmez; fakat 1909 yılında Hans Geiger ve Ernest Marsden, Rutherford'un laboratuvarında ve onun gözetiminde atomun yapısını çözmeye koyuldular.
Bunun için Rutherford'un alfa ismini verdiği parçacıkları kullandılar. Yaptıkları deney, esas itibariyle çok basitti. Atoma alfa parçacıklarını fırlatacak ve içinde ne olduğunu öğrenmeye çalışacaklardı. Yapacakları deney, bir iğne yardımıyla bir şeftalinin içerisindeki çekirdeği incelemek gibi bir şeydi. İğneyi şeftaliye batırarak içindeki "çekirdek"i keşfedeceklerdi.
Deneyde alfa parçacıklarını elde edebilmek için bir radon kaynak kullandılar. Radyoaktif olduğundan kendiliğinden alfa ışıması gerçekleştirebilecek olan radon kaynağı, bir yüzünde küçük bir delik olan ağır metal bir kutuya yerleştirdiler. Böylelikle alfa parçacıklarını bir istikamette odaklandırabileceklerdi. Kutudan çıkacak olan alfa parçacıklarının tam karşısına 0.00006 cm inceliğinde bir altın levha yerleştirdiler. Her şey neredeyse tamamdı; ama altın levhayla etkileşecek alfa parçacıklarının bu etkileşme sonucunda hangi yöne sapacağını tayin edebilmek gerekiyordu. Bunun için altın levhanın etrafını, üzerine alfa parçacıkları çarptığında ışınlar yayan çinkosülfit bir ekranla çevirdiler. Bu sayede ekrana çarpıp parlamaya neden olan alfa parçacıklarının ne kadarlık bir sapmaya maruz kaldıklarını kolaylıkla gözleyebileceklerdi.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fed023eee1d50a0817ae277591f52a494.jpg)
Deney sonuçları oldukça enteresandı. Parçacıkların neredeyse tamamı çok küçük sapmalarla altın levha engelinden geçiyordu; fakat sekiz binde biri, hareket yönü ters istikamette değişecek şekilde yöneliyordu. Bir hayli düşük bir oranla da olsa, parçacıkların sanki bir yansıma yaparmış gibi geriye yönelmeleri Rutherford’u da fazlasıyla şaşırtmıştı. Sonucu şöyle yorumladı:
Tıpkı bir peçeteye 15 inçlik bir mermi sıkmışsınız da mermi gerisin geri size dönmüş gibi.
Rutherford, meseleyi incelemeye koyuldu ve kısa zamanda deney sonuçlarını doğru olarak yorumlamayı başardı. Artı yüklü alfa parçacıklarının çok düşük bir oranda gerisingeri saçılması atomun ortasında küçük bir hacimde artı yükün yoğunlaşmasını gerektiriyordu. Bu yoğun kütleye çekirdek adını verdi. Alfa parçacıklarının yüksek bir oranda küçük açılı sapmalar göstermesi ise atomun çekirdek haricinde boşluklu bir yapıda olduğu gerçeğini gözler önüne seriyordu.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fe78a575b6649457980f795f32ac20745.jpg)
Rutherford alfa parçacıklarıyla çeşitli atomları bombardıman altına almanın daha başka keşiflere yol açabileceğini düşündü. Bu sefer alfa parçacıklarını nitrojen gazına yöneltti ve çinkosülfür ekranda alfa parçacıklarının haricinde hidrojen atomlarının ışımaya neden olduğunu gözlemledi. Hidrojen atomu ancak nitrojen atomlarından gelebilirdi ve bu durum nitrojen çekirdeklerinin hidrojen atomuna benzeyen artı yüklü parçacıklardan meydana geldiğini gösteriyordu. Bu parçacık daha sonraları "proton" olarak isimlendirilecekti.
Rutherford Atom Modeli Nedir? Çekirdekli Atom Modelinin Özellikleri Nelerdir?
Her element atomunun yapısını belirleyen de çekirdek içerisinde sahip olduğu artı yüklü parçacık sayısıydı. Atom nötr yapıda olduğundan artı yüklü parçacık sayısı kadar da elektron sahibi olmalıydı. Artık Rutherford kendi atom modelini oluşturmaya hazırdı ve 1911 yılına gelindiğinde çekirdekli atom modeli olarak da anılan atom modelini duyurdu:
- Atomda pozitif yükler çekirdek adı verilen çok küçük bir hacimde toplanmıştır.
- Atomda pozitif yüklü tanecikler kadar elektron vardır ve bu elektronlar çekirdek etrafındaki dairesel yörüngelerde dolanırlar.
- Elektronlar çekirdekten oldukça uzakta yer alırlar ve atom büyük oranda boşluktan oluşur.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fb11df1fc629cbdc3ee2f7eb5d0db1cfa.png)
Niels Bohr ve Kuantumun Doğuşu
Rutherford modeli oldukça mantıklı görünmesine rağmen, bazı çıkmazlara sahipti. İlk etapta Rutherford'u elektronların çekirdek etrafındaki yörüngelerde dolandığı düşüncesine iten sebep neydi, bu asla tam olarak anlaşılamadı. Ortada elektronların yörüngelerde dolandığına dair hiçbir kanıt yoktu. Öte yandan yörüngede dolaşan elektronlar, ışıyarak enerjilerini kaybettiğinden protonların çekim etkisiyle spiral yaparak çekirdeğe düşmeliydiler. Rutherford'un atomu, hesaplamalarda çok fazla yaşayamadan çöküyordu. Ama pratikte böyle bir şey gözlenmiyordu.
Rutherford atom modeli, katot ışınlarının oluşmasına neden olan elektronları da açıklayamıyordu. Atomun yapısı, elektronların özgürce yörüngesini terk ederek atomun dışına çıkmasına elverişli şekle sahip olmalıydı. Bütün bu sorular çok kısa bir süre içinde fiziğe yeni bir soluk getiren kuantum düşüncesiyle ve yine bu yeni kuantum akımının öncülerinden sayılan Niels Bohr tarafından cevaplandırılacaktı.
Kuantumun Doğuşu
20. yüzyılın başlarında Rutherford atomu alfa parçacıklarıyla bombalarken, onun deneyleri sonucunda oluşturacağı modelinin çıkmazlarını çözüme kavuşturacak yepyeni bir araştırma konusu doğuyordu. Bu konu, fiziksel meselelere yepyeni bir yaklaşım sergileyen kuantum düşüncesiydi.
Fizikte bir süredir ışığın bazı garip davranışlarının anlaşılmasına çalışılıyordu. İlk gariplik 1815 yılında Fraunhofer tarafından gözlenmişti. Güneş ışığını bir prizmadan geçiren Newton ortaya çıkan muhteşem güzellikteki yedi rengin karşısında çok muhtemel ki büyük bir heyecan duymuştur. Çünkü onun için her şey tamamıyla kusursuz görünüyordu. Fakat Fraunhofer, bu tayfı mikroskopla incelemek istedi ve sonucun heyecanlandırıcı olduğu kadar garipliklerle dolu olduğunu gördü. Tayfın bazı yerlerinde karanlık çizgiler vardı. Nedeninin anlaşılması için uzun bir zaman gerekecekti.
Takip eden yıllarda kara cisim ışıması denen bir anlaşılmazlıkla karşılaşıldı. Kara cisimler ışığı çok büyük oranda soğuran, aldığı enerjiyi biriktiren ve bu enerjiyle ışıyan cisimlerdir. Bu cisimlere "kara" denmesinin sebebi de tüm ışığı soğurduklarından siyah görünmeleridir. Bir kara cisim ısıtıldığında tıpkı metal bir teli ısıtıyormuş gibi ışımanın enerjiye bağlı olarak renk değiştirdiği gözlemlenir. Işıma önce kırmızı renktedir ve ısıtma devam ettikçe ışıma tayf boyunca maviye doğru kayar. Buraya kadar hiçbir sorun yok; fakat mesele, ışımalara matematiksel denklemlerle yaklaşmaya gelince ortaya büyük sorunlar çıkar. O zamana kadar bugün bizim "klasik fizik" diye tabir ettiğimizden başka bir fizik yoktur. Olaya klasik fizik denklemleriyle yaklaşılınca ışıma maviye doğru gittikçe (dalgaboyu küçüldükçe) şiddetin sonsuza gittiği görülür.
Denklemler deney sonuçlarıyla tamamıyla bir uyumsuzluk içindedir. Adeta klasik fizik tıkanmıştır. Kara cisim ışıması üzerine Alman fizikçi Max Planck çalışır ve sonuçlara matematiksel bir farklılık getirdi. Öyle ki kara cisimlerden yayılan enerji sürekli değil de bir tamsayının katları olarak ele alındığında denklemler sonuçlarla tamamıyla uyuşmaktadır. Bu bakış açısı ve getirdiği yeni fikirler Planck'ın öncülüğünde fizikte yeni bir alan doğurmuştur. Enerjinin kuantumlu (kesikli) olabileceği fikri bütün anlaşılmazlıkları çözdü ve birim enerji paketleri fikriyle ulaşılan tamsayı, bugün Planck sabiti olarak anılan sayıdır.
Yüzyıllar önce Demokritos maddenin sürekli olduğu fikrini nasıl bir kenara ittiyse 1901 yılında Planck da enerjinin sürekliliğine bir darbe vuruyordu. Kuantum düşüncesi hiç şüphesiz fizikte bir devrimi başlatmıştı ve bu devrim atom teorilerinin gelişmesini doğrudan etkileyecekti. Enerjinin kesikli oluşu kara cisim problemini aşmamızı sağlıyordu; ama Fraunhofer'ın gözlemi hala soru işaretleriyle doluydu. Bunun çözümü için yeni bir atom teorisi gerekecekti.
Bohr Atom Modelinin Doğuşu
1911 yılında Rutherford, yeni atom modelini oluşturduğunda, kuantum düşüncesi birçok fizikçiyi olduğu gibi çok muhtemeldir ki onu da pek etkilememişti. Bu yüzden atom modelini kuantum düşüncesiyle yorumlamayı hiç düşünmedi. Diğer taraftan sadece kuantum düşüncesiyle hareket ederek de yeni bir atom modeli geliştirmek imkânsızdı. Rutherford'un modelinin tüm kazanımlarını ve çıkmazlarını kuantum fikriyle değerlendirip yeni bir model oluşturacak kişi Niels Bohr'du.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fc054e0424f99149eb5f70787a0854823.jpg)
Borh Atom Modeli Nedir? Özellikleri Nelerdir?
Bohr, 1913 yılında Rutherford’un atom modelini ve enerjinin kuantumlu olduğu fikrini alıp bir potada eriterek yeni bir model oluşturdu:
- Elektronlar çekirdek çevresinde rastgele dairesel bir yörüngede değil, belli enerjiye sahip olan dairesel yörüngelerde bulunabilirler.
- Elektronlar bulundukları enerji seviyesinin enerjisine sahiptir. Enerji seviyeleri atom çekirdeğine yakınlığına göre n = 1, 2, 3, 4, 5, 6 gibi tamsayılarla veya K, L, M, N, O, P, Q gibi harflerle ifade edilirler. Bu konuda daha fazla bilgiyi buradan alabilirsiniz.
- Yüksek enerji düzeyinde bulunan bir elektron daha düşük enerji düzeyine geçerse fotonlar halinde ışık enerjisi yayar, tersi bir şekilde bir elektron bulunduğu enerji düzeyinden daha yüksek bir enerji düzeyine geçebilmek için dışardan enerji almalıdır. Bir atomun elektronları dışardan enerji alarak yüksek enerji düzeyine yükselirse bu atoma "uyarılmış atom" denir.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2F612b6b3a2115369429b2a0cec3fe5f13.jpg)
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2F6ec2de0c0ced289cbeba72b88de3b085.png)
Bohr atom kuramı, Fraunhofer'ın gözlemini açıklayabiliyordu. Güneş ışınlarının bir kısmı atmosferdeki atomların elektronlarınca emilerek tayftan siliniyordu. Üstelik tayfın karanlık çizgilerinin sürekli değil de birkaç tane olması Bohr'un modelindeki elektronların ancak belli yörüngelerde bulunabileceği fikrini destekliyordu. Elektronların yalnız belli yörüngelerde bulunması fikri enerjilerini kaybetmedikleri ve neden çekirdeğe düşmediklerini açıklıyordu fakat modelin hala yetersiz olduğu yerler vardı.
Sonraki yıllarda Bohr, modelini periyodik tablodaki periyodikliği de açıklayacak biçimde genişletti. Elektronlar belli yörüngelerde (ilkinde 2 ve sonrakilerde 8 olmak üzere) ancak belli sayılarda bulunabiliyorlardı. Yörüngelerden biri dolunca elektronlar bir üst yörüngeye yerleşiyorlar ve kimyasal özellikler dış yörüngedeki elektron sayısıyla açıklanabiliyordu. Dış kabuğu dolu olan element tepkimeye girmiyordu. Bohr’un modeli önemli açıklamalar getirmişti fakat hala bir şeyler eksikti. Her şeyin ötesinde elektronlar neden sadece belli yörüngelerde bulunabiliyordu? Elektron bir parçacıktı ve belli enerji düzeyleri fikri ışıma için yani dalga için düşünülebilirdi.
Atomun Kuantum Doğası: Atomun "Boşluklarını" Doldurmak
Hem Dalga Hem Parçacık...
1923 yılında Arthur Compton yeni bir keşif gerçekleştirdi. Compton Etkisi veya Compton Saçılımı denilen ve kendisine Nobel Ödülü'nü getiren bu keşifte Compton, ışık demetinin elektronlara çarpıp bir kısım enerjilerini aktardıklarını ve elektronların ivmelenmelerine neden olup geriye kalan enerjileriyle yansıdıklarını gördü. Aslında bu etki daha önceleri de biliniyordu fakat ışık bir dalga olarak ele alındığından, teorik çözümlerde dalga denklemleri kullanılıyordu ve denklemler bir kez daha gözlemlerle uyuşmuyordu. Compton, bu etkinin, enerjinin ve momentumun korunumu gibi fiziğin bilinen olgularıyla açıklanabileceğini gösterdi ve bu durum kimi zaman ışığın bir parçacık gibi değerlendirilebileceğinin ispatıydı.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2F380cca2b55e7e1b08579d7470153e0ad.png)
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Feaa28cd4a97dbf592ac04ddce7915435.jpg)
Hem dalga hem parçacık özellikler gösteren ışığın bu ikiliğinden yola çıkan Fransız fizikçi Louis de Broglie, eğer dalgalar parçacık özelliği gösterebiliyorsa parçacıklarında dalga özelliği gösterebileceklerini düşündü. 1923’te yayınladığı doktora tezinde her parçacığın bir dalga özelliği taşıyabileceğini ortaya koydu ve elektronun dalga boyunu hesapladı. Yaptığı hesap elektron yörüngelerinin neye göre belirlendiğine mantıklı bir çözüm getirebiliyordu. Hesapları herhangi bir yanlışlık taşımıyor olsa bile parçacık özellikleri tamamıyla bilinen elektronun dalga özelliği gösterebileceğine dair henüz hiçbir deneysel kanıt yoktu.
Pauli Dışlama İlkesi ve Elektron Spini
Wolfgang Pauli, 1925 yılında elektronların neden aynı kuantum durumunu paylaşamadıklarını açıklayan bir yasa keşfetti. Pauli Dışlama İlkesi olarak bilinen bu yasa, Bohr atom modelinde elektronların neden farklı yörüngelerde olmaları gerektiğini açıklıyor; fakat neden her yörüngede iki elektron olduğunu açıklayamıyordu. İki elektronun aynı yörüngeyi paylaşabilmeleri için bir farklılıkları olması gerekiyordu. Bu sorun George Uhlenbeck ve Samuel Goudsmit’in ortaya attığı spin kavramıyla aşıldı. Spin kavramı, elektronların açısal momentumunun bir ifadesiydi. Bu kavrama göre aynı enerji düzeyini paylaşan elektronlar birbirlerine göre ters spin değerlerine sahipti ve böylelikle neden her yörüngede iki elektron bulunduğu açıklanmış oluyordu.
Schrödinger Dalga Denklemi
Broglie’nin varsayımından hareket eden Avusturyalı fizikçi Erwin Schrödinger 1926 yılında harikulade bir denklem oluşturdu. Öyle ki bu denklemin çözümleriyle bütün parçacıkları ifade etmek mümkündü. Tamamıyla yeni bir mekanik alanı olan Kuantum Mekaniği'ni sistematik bir şekilde önemini ortaya koyan bu denklem, Schrödinger dalga denklemi olarak bilinen denklemdir.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2F7a7d5a657184548e6fd49f482e7abc0d.jpg)
Parçacıkların dalgalar gibi görülebileceği fikri giderek güç kazanıyordu; fakat Schrödinger’in dalga denklemine yeni ve mantıklı bir yaklaşım sergilenmesi gerekliydi. Bu yeni yorum, Max Born tarafından getirildi ve Born kendi ismiyle anılan yakınsama metotlarıyla dalga fonksiyonunun karesinin, parçacığın herhangi bir zamanda herhangi bir yerde bulunma olasılığını verdiğini gösterdi.
Born'un getirdiği yoruma göre bir parçacığın herhangi bir noktada kesin olarak bulunacağını söyleyebilmek olanaksızdır. En fazla yapacağınız parçacığın o noktada hangi olasılıkla bulunabileceğini belirlemektir. Daha sonrasında yaptığınız ölçümle bu olasılığı kırıp parçacığın nerede olduğunu gözlemleyebilirsiniz. Yeni bir ölçümde parçacık yer değiştirmiş olabilir çünkü ölçümü her tekrarladığınızda parçacığın belli yerlerde belli bulunma olasılıkları olduğu gerçeği değişmez.
Heisenberg'in Belirsizlik İlkesi
Kuantum dünyası aklın ötesine geçen hayaller doğuruyordu. Bir parçacığın nerede olduğunun asla kesin olarak belirlenemeyeceğini ancak olasılıklarla ifade edilebileceğini öğrenen fizikçiler, bütün bu kuantum sonuçları üzerine bir de belirsizlik ilkesiyle tanıştılar. Atomu tanıma süreci, birbiri ardına gelen gerçeklerle insanlığı kuantum dünyasına taşıyordu.
Herhangi bir nesnenin konumunu belirleyebilmemiz için onu gözleyebilmemiz gerekir. Yani onu görebilmemiz. Nesneye çarpıp gözümüze veya herhangi bir algılayıcıya gelen ışıkla bu görme faaliyetini gerçekleştiririz. Peki, bir elektronu gözlemek istersek işler nasıl değişir?
Küçüklerin dünyasında da bizim çevremizdeki gözlemlere benzer sonuçlar elde edilebilir mi?
Işığın bir dalga olduğunu dolayısıyla bir dalgaboyu değerine sahip olduğunu biliyoruz. Elektron çevremizdeki herhangi bir nesneyle asla karşılaştırılamayacak kadar küçük bir boyutta olduğundan onu görebilmek için kullanacağımız ışığın dalgaboyuyla elektronumuzun boyutlarını mukayese etmeliyiz. Sonuç itibariyle ışığımızın dalgaboyu elektron çapımızdan büyük olmamalı aksi halde onu net bir şekilde göremeyiz. Pekâla, dalgaboyu elektron çapından küçük olan bir ışığı göndersek ne olur?
Cevap, Compton etkisinde saklıydı: Işığın dalgaboyu küçüldükçe enerjisinin arttığını, ışığın bir parçacık olarak düşünülebileceğini ve bu parçacıklara da foton ismi verildiğini biliyoruz. Küçük dalgaboylu ve yüksek enerjili foton elektrona çarptığında enerjisinin bir kısmını aktarır ve elektronun momentumu değişir. Dolayısıyla elektronun momentumunda değişikliğe sebep vermeden konumunu öğrenmek mümkün değildir.
Peki, ışığın dalgaboyunu büyütsek ve dolayısıyla daha düşük enerjili fotonlar göndersek ne olur? Bu seferde dalgaboyu elektron çapından büyük olduğundan her ne kadar elektronun momentumunda daha düşük bir değişime sebep versek de konumunu belirlemeye yönelik belirsizliğimiz artar. Elektron, ışığın dalgaboyunun, kendisinden büyüklüğü oranında belirsiz konumlara sahip olabilir.
İşte 1927 yılında Werner Heisenberg de aynen böyle düşündü ve belirsizlik ilkesini öne sürdü:
Herhangi bir parçacığın momentumu ve konumu aynı anda tam doğrulukla ölçülemez.
Young Deneyi ve Thomson Deneyi
Birbiri ardına gelen tüm bu gelişmeler atom teorisinin kuantum düşüncesiyle açıklanabileceğini gözler önüne seriyordu fakat hala bu düşünceden şüphe duyanlar vardı. Bir parçacık nasıl dalga özelliği gösterebilirdi? Cevap, Heisenberg’in belirsizlik ilkesini geliştirdiği aynı yılda, 1927’de, elektronların varlığını ortaya koyan J. J. Thomson'ın oğlu George Paget Thomson’dan geldi.
Paget Thomson'ın yaptığı deneyi anlayabilmek için biraz eskilere gitmek gerekir çünkü deneyin neredeyse aynısını 1801 yılında Thomas Young yapmıştır. Young, iğne deliğinden geçirdiği ve böylelikle tek bir merkezde odakladığı güneş ışığının yolu üzerine, üstünde iki küçük yarık bulunan bir plaka koymuştu. Düzeneğin sonuna ışığın yarıklarla olan etkileşiminin sonucunu görmek için de bir perde yerleştirmişti. Yarıklardan geçen ışık perdede aydınlık ve karanlık saçaklar oluşturacak şekilde bir girişim deseni meydana getirmişti ve girişim deseni ancak dalgalar tarafından gözlenebilecek bir olgu olduğundan deney açıkça ışığın dalga özelliği gösterdiğini kanıtlamıştı.
Paget Thomson benzer bir deneyi fakat bu sefer elektronları kullanarak gerçekleştirmek istedi. Sonuç oldukça şaşırtıcıydı. Perdede tıpkı dalga özelliğiyle bilinen ışığın oluşturduğu gibi aydınlık ve karanlık saçaklarıyla bir girişim deseni vardı ve bu durum Broglie’nin elektronların dalga özelliği gösterebileceğine dair geliştirdiği fikrini açıkça destekler nitelikteydi.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fc3010d87df8aa409df4847c6b83c508c.png)
Nötronun Keşfi
Nötronların keşfinin kökenlerini 1930 yılında Alman nükleer fizikçi Herbert Becker ve Walther Bothe'nin çalışmalarına kadar takip etmek mümkündür. Bu ikili, polonyum atomundan saçılan alfa parçacıklarının kısmen daha hafif olan lityum, berilyum veya bor gibi elementler üzerine düştüğünde radyasyon ürettiğini gözlemiştir. Bu penetre edici radyasyon, elektrik alandan etkilenmiyordu ve dolayısıyla bir çeşit gama ışını olduğu düşünüldü.
1932 yılında Fransız bilim insanları Frederic Joliot-Curie ve Irene Joliot-Curie (ki ikincisi, Marie Curie'nin kızıdır), bu ilginç penetre edici radyasyonun hidrojence zengin parafin mum üzerine düşmesi halinde yüksek enerjili (~5 MeV düzeyinde) protonlar ürettiğini gözlemiştir. İtalyan fizikçi Ettore Majorana, atom çekirdeğinde nötr parçacıklar olduğunu ve bunların radyasyonun protonla etkileşme biçiminden sorumlu olduğunu ileri sürdü; ancak o da bunu deneysel olarak gösteremedi.
1920 yılında Ernest Rutherford da atom çekirdeğinde nötral parçacıklar olabileceğini ileri sürmüştü: Ona göre bu nötr yüklü parçacıklar, birbirine yapışmış bir proton ve elektrondan oluşuyordu ve atomun çekirdeğinde yer alıyordu. Bu nötral parçacıklardan söz etmek için "nötron" sözcüğünü ileri sürdü; ancak bu yapıların varlığını o da deneysel olarak gösteremedi.
Gerçekten de nötronlar, protonlarla beraber atomun çekirdeğinde bulunurlar. Kimyanın erken zamanlarında çekirdekte sadece protonların olduğu tahmin ediliyordu. Fakat çekirdeğin için sadece (+) yüklü protonlar bulunursa bunlar birbirlerini büyük bir kuvvetle iteceklerdi. Bu yüzden protonların yanında, onların bir arada kalmasına yardımcı olacak parçacıkların olduğu tahmin edildi. Bu parçacıkların gerçekten de var olduğunu, Ernest Rutherford'un yanında doktora öğrencisi olarak çalışan James Chadwick, 1932 yılında keşfetmiştir.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fc67004162c51b322b3936be9352717f3.jpg)
Bunu başarabilmek için, bir polonyum kaynağında ürettiği alfa radyasyonu berilyum tabakasına ateşlemiştir. Böylece yüklü olmayan, penetre edici radyasyon üretmişti. Bu radyasyonu bolca hidrojen içeren bir hidrokarbon olan parafin mum üzerine düşüren Chadwick, protonların saçıldığını gözlemiştir. Bu özgür bırakılan protonların niteliklerini ve diğer atomlarla etkileşimini inceleyen Chadwick, bu parçacıklardan bir kısmının protonlar gibi yüklü olmadığını, ancak proton ile kabaca aynı kütleye sahip olduğunu gözlemiştir. İşte bunlara "nötron" adı verilmiştir.
Modern Atom Teorisi (Kuantum Atom Modeli)
Atomun kuantum modeli artık oluşturulmaya hazırdır. Bu model Modern Atom Teorisi veya kimi zaman Schrödinger Atom Modeli olarak da anılır ve herhangi bir şekilde resmedilmesi elektron davranışları sebebiyle pek mümkün olmayan düşünsel bir modeldir. Kuantum modeli, Bohr'un modelinin devamı niteliğinde olup onun açıklayamadığı elektronların neden sadece belli yörüngelerde dolandığı gerçeğini açıklar.
Schrödinger Atom Modeli
Elektronlar, dalga karakterlerinin bir özelliği olarak çevresi, elektron dalgaboyunun ancak tamsayı katında olan yörüngelere yerleşebilirler. Dolayısıyla çevresi "üç buçuk elektron dalgaboyu büyüklüğünde bir yörünge"den söz edilemez. Bunun yanı sıra dışlama ilkesi gereği elektronlar farklı yörüngelerde olmak zorundadır ve Born’un olasılık kuramı gereği bir elektronun yerini kesin olarak ifade etmek mümkün değildir. Bütün bunların ışığında elektronlar çekirdeğin etrafında ancak bir elektron bulutu içinde resmedilebilirler.
:sharpen(0.5,0.5,true)/old%2Fcontent_media%2Fc812ec255c09db7720bea78dc9eeea27.jpg)
Kuantum fiziğinin giderek daha sağlam bir yapıya oturmasıyla madde olarak adlandırdığımız olguya bakışımız değişti. Bu yeni anlayışa göre kuantum parçacıklarının davranışları bizim bildiğimiz maddeden çok farklıydı. Bu olay en belirgin hali ile tek yarık deneyinde gözlemlenmektedir.
El feneri benzeri güçlü bir ışık kaynağından çıkan bir ışının duvar gibi düz bir yüzeye vurduğunu düşünün. Ancak bu el feneri geniş bir alanı değil de sadece belli üzüm tanesi kadar küçük bir alanı aydınlatsın. Şimdi bu ışığın izlediği yolun üzerine bir engel koyalım, ancak bu engel şimdilik ışığın yolunu kapatmasın ve sadece üzüm tanesi genişliğinde bir açıklığı olsun. Şimdi bu açıklığı her iki tarafından hafifçe kapatalım. Ekranın üzerinde garip bir olay olduğunu göreceksiniz. Siz ışığın geçebileceği aralığı daralttıkça ekranın üzerine düşen ışık giderek genişlemeye başlayacak. Aralık küçüldükçe ekrana düşen ışığın genişliği artacak, ta ki siz deliği tamamen kapatana kadar.
Peki, burada tam olarak ne oldu? Heisenberg bu soruya az yukarıda da değindiğimiz belirsizlik ilkesi ile bir açıklama getirdi. Siz ışığın geçtiği aralığı daralttıkça o aralıktan geçen fotonların yerini daha kesin bir şekilde ölçmüş oluyorsunuz. Ve yerini daha kesin ölçtükçe fotonların momentumları belirsizleşiyor ve ekranda farklı noktalara düşmeye başlıyorlar.
Bu fikirden yola çıkarak Schrödinger elektronların da dalga gibi hareket ettiğini göz önüne alarak Bohr modelinde gösterilen yörüngelerin mümkün olamayacağını fark etti. Bunun üzerine Heisenberg'in bulgularından hareket ederek bu yörüngeler yerine paketler halinde dağılmış bulutlar içerisindeki elektronlar için gerekli hesaplamaları yaptı. Bu şekilde elektronların neden çekirdeğe düşmediğini de açıklamış oldu, çünkü elektronların çekirdek gibi küçük bir alana düşmeleri elektronların yerini tam olarak bilmemiz anlamına gelecekti, bu da belirsizlik ilkesine aykırıydı. Ve oluşturduğu Schrödinger denklemi olarak bilinen formülü 1926 yılında dünya ile paylaştı.
Bu modelde artık düzgün yörüngeler yerine elektronların bulunmasının muhtemel olduğu alanlar (elektron bulutları) bulunmaktaydı. Yani günlük hayatta alışık olduğumuz katı ve anlaşılır madde olarak tanımladığımız elektron gitmiş, yerine bir deniz yüzeyi gibi dalgalanan bir elektron alanı gelmişti. Elektron bu denizde bir yerlerdeydi, ama yerini tam olarak bilmek olanaksızdı.
Sonradan Gelen Güncellemeler
Bunların yanı sıra Paul Dirac birtakım matematiksel hesaplama sonucu bilinen bütün bu parçacıkların birer karşı parçacığı olduğunu öne sürdü. Sonraki yıllarda, bu karşı parçacıkların tamamı gözlendi.
Kuarklar: Atomu Oluşturan Parçaları Oluşturan Parçalar
Daha da heyecan verici olanı, Demokritos'un atomlarını oluşturan parçacıkların bile daha küçük parçacıklardan oluştuğunun keşfiydi: Atomaltı parçacıklar, kendi aralarında kuarklar ve leptonlar olmak üzere iki kola ayrılmışlardır. Güçlü kuvvet tarafından bir arada tutulan kuarklardan oluşan birleşik parçacıklara hadronlar adı verilir ve bunlar da baryonlar ve mezonlar olarak kendi arasında ikiye ayrılır. Baryonlara vereceğimiz en tanıdık örnekler protonlar ve nötronlardır. Baryonların kütleleri, protonların kütlelerine eşit ya da daha büyüktür. Pion ve kaon gibi çeşitleri bulunan mezonlarsa kararsızdırlar; bu nedenle günlük yaşamda kullanılan materyallerin yapısında bulunmazlar.
Yapılan parçacık çarpıştırma deneyleri işte tüm bu hadronların, daha da alt parçacıklardan oluştuğunu göstermiştir. 1963 yılında Murray Gell Mann ve George Zweig adlı bilim insanları, oluşturdukları modelde, hadronları oluşturan bu parçacıkları kuark olarak adlandırdılar. Günümüzde bu kuarkların yukarı, aşağı, tuhaf, tılsımlı, üst ve alt şeklinde altı tane olduğu ve bunların karşıt parçacıklarının (yani zıt yüklü antikuarkların) bulunduğu bilinmektedir.
Leptonları ele alacak olursak: Bunlar temel parçacık olduğu için, hadronlar gibi daha küçük yapılara ayrılamazlar. Leptonlar da altı çeşittir, bunlar; elektron, elektron nötrinosu, müon, müon-nötrinosu, tau ve tau-nötrinosudur. Yine, leptonların da karşıt parçacıkları deneysel olarak gözlenmiştir. Örneğin elektronun karşıtı olan pozitron adlı parçacık günümüzdeki PET (Pozitron Emisyon Tomografisi) tıbbi görüntüleme tekniğinin temelinde yer alır. Öte yandan atomaltı fizik dünyasını mükemmel bir şekilde tasvir etmekte olan ve Standart Model olarak adlandırılan tüm bu genel teoriye göre etkileşmelere aracılık eden temel parçacıklar ise fotonlar, zayıf arabozonlar ile gluonlardır.
Sicimler: Atomu Oluşturan Parçaları Oluşturan Parçaları Oluşturan Parçalar
Parçacık fizikçileri tarafından ortaya atılmış olan, kuantum mekaniği ile Einstein'ın Genel Görelilik Teorisi'ni birleştirmeyi hedefleyen ve Sicim Teorisi adı verilen yeni bir teoriye göre, atomaltı parçacıkların da çok küçük sicimlerden (1 Angströmden milyarlarca defa daha kısa) meydana geldiği varsayılıyor. Daha doğrusu, açık ya da kapalı olabilen bu sicimlerin titreşim kipleri, temel parçacıklara karşılık geliyor.
Sicim teorisinin ve öngörülerinin kanıtlanması çok uzun yıllar alabilir, çünkü hem matematiksel olarak çözüm bekleyen birçok yönleri var. Henüz atomaltı temel parçacıkların içine inerek görüntüleyebilecek kadar gelişmiş bir çarpıştırıcı teknolojimiz maalesef yok. Belki bu nedenle 1980’li yıllarda açığa çıkan bu teorinin artık eskisi kadar çekici bir model olmadığı belirtiliyor. Sicim teorisine dair gelişmeler ve benzer diğerleri günümüz bilim insanlarının araştırdığı konulardır ve doğruluğunu ancak zaman gösterecektir.
Sonuç
Tüm bu anlattıklarımızdan sonra, Demokritos'un haksız olduğunu düşünebilirsiniz. Bu, yanıltıcı olurdu! Modern fizik bilgilerimiz ışığında bildiğimiz kadarıyla Demokritos, her zaman haklı olacaktır. Çünkü her "bölünemez" diye nitelendirilen parça bölündüğünde, işler Yunanlı filozoftan yana olacak biçimde yine "bölünemez" yeni parçacıkların keşfini doğurmaktadır. Evet, belki o "bölünemez" seviye, Demokritos'un sandığı gibi bizim bugün "atom" dediğimiz yapı değildir. Ancak Demokritos da, bizim bugün "atom" dediğimiz şeye "atom" demiyor, maddenin bölünemez en küçük parçası her neyse, ona "atom" diyordu. Dolayısıyla bilimsel donanımımız gelişip, atomun daha da derinliklerine indikçe, çok büyük olasılıkla Demokritus'un "bölünemeyen atomosları" keşfedilecektir!
Parçacık fiziğindeki gelişmeler bugün hala atom teorilerine ışık tutuyor. Maddeyi oluşturan, rakyoaktiviteyi taşıyan, doğanın temel kuvvetlerinden sorumlu olan birçok parçacık ortaya çıkarıldı. Bu parçacıklar bize evrenin sırlarını da fısıldıyorlar. Bilim bitmek tükenmek bilmeyen merakı sonucu aydınlattığı atom fikri gibi bugün doğanın birçok gizli kalmış yanını ortaya çıkarmak için uğraşıyor. Hiç şüphesiz bugünün uğraşları ileride yeni bilimsel öykülere konu olacak.
Evrim Ağacı'nda tek bir hedefimiz var: Bilimsel gerçekleri en doğru, tarafsız ve kolay anlaşılır şekilde Türkiye'ye ulaştırmak. Ancak tahmin edebileceğiniz gibi Türkiye'de bilim anlatmak hiç kolay bir iş değil; hele ki bir yandan ekonomik bir hayatta kalma mücadelesi verirken...
O nedenle sizin desteklerinize ihtiyacımız var. Eğer yazılarımızı okuyanların %1'i bize bütçesinin elverdiği kadar destek olmayı seçseydi, bir daha tek bir reklam göstermeden Evrim Ağacı'nın bütün bilim iletişimi faaliyetlerini sürdürebilirdik. Bir düşünün: sadece %1'i...
O %1'i inşa etmemize yardım eder misiniz? Evrim Ağacı Premium üyesi olarak, ekibimizin size ve Türkiye'ye bilimi daha etkili ve profesyonel bir şekilde ulaştırmamızı mümkün kılmış olacaksınız. Ayrıca size olan minnetimizin bir ifadesi olarak, çok sayıda ayrıcalığa erişim sağlayacaksınız.
Makalelerimizin bilimsel gerçekleri doğru bir şekilde yansıtması için en üst düzey çabayı gösteriyoruz. Gözünüze doğru gelmeyen bir şey varsa, mümkünse güvenilir kaynaklarınızla birlikte bize ulaşın!
Bu makalemizle ilgili merak ettiğin bir şey mi var? Buraya tıklayarak sorabilirsin.
Soru & Cevap Platformuna Git- 190
- 176
- 122
- 102
- 67
- 58
- 45
- 6
- 4
- 3
- 2
- 0
- D. Halliday, et al. (2004). Fundamentals Of Physics. ISBN: 9780471232315. Yayınevi: Wiley.
- S. Sekmen. (2007). Parçacık Fiziği: En Küçüğü Keşfetme Macerası. ISBN: 9789944344166. Yayınevi: ODTÜ Yayıncılık.
- C. Yıldırım. (2016). Bilim Tarihi. ISBN: 9789751417244. Yayınevi: Remzi Kitabevi.
- M. Taşkan. (2011). Fizikte 10 Teori. ISBN: 9786051273433. Yayınevi: Cinius Yayınları.
- L. Buescher. Atomic Structure Timeline. (25 Mart 2019). Alındığı Tarih: 25 Mart 2019. Alındığı Yer: Atomic Timeline | Arşiv Bağlantısı
- LeMoyne College. A New System Of Chemical Philosophy. (25 Mart 2019). Alındığı Tarih: 25 Mart 2019. Alındığı Yer: LeMoyne College | Arşiv Bağlantısı
- American Institute of Physics. The Discovery Of The Electron. (25 Mart 2019). Alındığı Tarih: 25 Mart 2019. Alındığı Yer: American Institute of Physics | Arşiv Bağlantısı
- E. W. Weisstein. Lavoisier, Antoine (1743-1794). (1 Ocak 2007). Alındığı Tarih: 17 Mayıs 2019. Alındığı Yer: Wolfram | Arşiv Bağlantısı
- H. M. Leicester. Joseph-Louis Proust (1754-1826). (1 Ocak 1952). Alındığı Tarih: 17 Mayıs 2019. Alındığı Yer: Lemoyne University | Arşiv Bağlantısı
- H. M. Leicester. John Dalton (1766-1844). (17 Mayıs 1952). Alındığı Tarih: 17 Mayıs 2019. Alındığı Yer: Lemoyne University | Arşiv Bağlantısı
- E. Rutherford. (1911). The Scattering Of Α And Β Particles By Matter And The Structure Of The Atom. Philosophical Magazine, sf: 669-688. | Arşiv Bağlantısı
- N. Bohr. (1913). On The Constitution Of Atoms And Molecules. Philosophical Magazine, sf: 1-24. | Arşiv Bağlantısı
- G. Hooft. Maddenin Son Yapitaslari. ISBN: 9789754031935.
- G. L. Kane. (2009). Süpersimetri. ISBN: 9789754035070. Yayınevi: Tübitak Yayınları.
- S. F. Mason. (2013). Bilimler Tarihi. ISBN: 9789751627094. Yayınevi: Türk Tarih Kurumu.
- C. Yıldırım. (2012). Bilim Tarihi. ISBN: 9789751403148. Yayınevi: Remzi Kitabevi.
- M. I. Grossman. (2021). John Dalton’s “Aha” Moment: The Origin Of The Chemical Atomic Theory. Ambix, sf: 49-71. doi: 10.1080/00026980.2020.1868861. | Arşiv Bağlantısı
- J. J. . T. . F. R. S.. (2009). On The Structure Of The Atom: An Investigation Of The Stability And Periods Of Oscillation Of A Number Of Corpuscles Arranged At Equal Intervals Around The Circumference Of A Circle; With Application Of The Results To The Theory Of Atomic Structure. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, sf: 237-265. doi: 10.1080/14786440409463107. | Arşiv Bağlantısı
- Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. (1913). Rays Of Positive Electricity. Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, sf: 1-20. doi: 10.1098/rspa.1913.0057. | Arşiv Bağlantısı
- H. Kragh. (2012). Niels Bohr And The Quantum Atom: The Bohr Model Of Atomic Structure 1913–1925. Oxford University Press. doi: 10.1093/acprof:oso/9780199654987.001.0001. | Arşiv Bağlantısı
- J. Chadwick. (1932). Possible Existence Of A Neutron. Nature, sf: 312-312. doi: 10.1038/129312a0. | Arşiv Bağlantısı
- D. M. Appleby. (2016). Quantum Errors And Disturbances: Response To Busch, Lahti And Werner. Entropy, sf: 174. doi: 10.3390/e18050174. | Arşiv Bağlantısı
- P. Busch, et al. (2013). Proof Of Heisenberg’s Error-Disturbance Relation. Physical Review Letters, sf: 160405. doi: 10.1103/PhysRevLett.111.160405. | Arşiv Bağlantısı
- B. Pullman. (2001). The Atom In The History Of Human Thought. ISBN: 9780195150407. Yayınevi: Oxford University Press, USA.
- A. Grafton. (2010). The Classical Tradition. ISBN: 9780674035720. Yayınevi: Belknap Press.
Evrim Ağacı'na her ay sadece 1 kahve ısmarlayarak destek olmak ister misiniz?
Şu iki siteden birini kullanarak şimdi destek olabilirsiniz:
kreosus.com/evrimagaci | patreon.com/evrimagaci
Çıktı Bilgisi: Bu sayfa, Evrim Ağacı yazdırma aracı kullanılarak 08/02/2026 11:12:31 tarihinde oluşturulmuştur. Evrim Ağacı'ndaki içeriklerin tamamı, birden fazla editör tarafından, durmaksızın elden geçirilmekte, güncellenmekte ve geliştirilmektedir. Dolayısıyla bu çıktının alındığı tarihten sonra yapılan güncellemeleri görmek ve bu içeriğin en güncel halini okumak için lütfen şu adrese gidiniz: https://evrimagaci.org/s/109
İçerik Kullanım İzinleri: Evrim Ağacı'ndaki yazılı içerikler orijinallerine hiçbir şekilde dokunulmadığı müddetçe izin alınmaksızın paylaşılabilir, kopyalanabilir, yapıştırılabilir, çoğaltılabilir, basılabilir, dağıtılabilir, yayılabilir, alıntılanabilir. Ancak bu içeriklerin hiçbiri izin alınmaksızın değiştirilemez ve değiştirilmiş halleri Evrim Ağacı'na aitmiş gibi sunulamaz. Benzer şekilde, içeriklerin hiçbiri, söz konusu içeriğin açıkça belirtilmiş yazarlarından ve Evrim Ağacı'ndan başkasına aitmiş gibi sunulamaz. Bu sayfa izin alınmaksızın düzenlenemez, Evrim Ağacı logosu, yazar/editör bilgileri ve içeriğin diğer kısımları izin alınmaksızın değiştirilemez veya kaldırılamaz.

:sharpen(0.5,0.5,true)/evrimagaci.org%2Fpublic%2Fimages%2Flogo-50.png)