Protein Nedir? Amino Asitler ve Proteinler, Canlılar İçin Neden Önemlidir?
/old/content_media/40ecf243ef642baa254322028bc1e473.jpg) The Conversation
The Conversation
- Özgün
- Biyokimya
- Hücre Biyolojisi
Bu Makalede Neler Öğreneceksiniz?
- Proteinler, amino asitlerin peptit bağlarıyla bağlanması sonucu oluşan büyük biyomoleküller olup, canlıların yaşamsal faaliyetlerinde enzimatik ve yapısal görevler üstlenirler.
- Amino asitler, karbon, hidrojen, oksijen, azot, fosfor ve kükürt elementlerinden oluşan, yan gruplarına göre farklı özellikler gösteren 20 temel çeşide sahiptir ve proteinlerin çeşitliliğini sağlarlar.
- Miller-Urey deneyi gibi çalışmalar, amino asitlerin doğal koşullarda oluşabileceğini ve amino asitlerin birleşerek proteinleri oluşturduğunu göstererek canlılığın kimyasal evrimini desteklemektedir.
Proteinler, içerisinde çok sayıda amino asit içeren bir veya birden fazla amino asit zincirinden oluşan büyük biyomoleküller ve makromoleküllerdir. Proteinler organizmada öylesine çoktur ki, proteinler, birçok hücrenin kuru ağırlığının yarısından daha fazlasını oluştururlar.
Canlıların neredeyse bütün yaşamsal faaliyeti (hareket, solunum vd.) proteinler sayesinde gerçekleştirilir: Proteinler, canlıların vücudunda metabolik reaksiyonları katalize etmek, DNA replikasyonu, uyaranlara tepki verme, hücrelere yapı kazandırma, molekülleri bir yerden bir diğer yere taşıma gibi çok sayıda göreve sahiptir. Buna ek olarak birtakım proteinler hücre içi kimyasal tepkimelerinin hızını arttırırken, diğer protein grupları savunma, depolama, taşıma, hücresel haberleşme, hareket ya da yapısal destek sağlamada görev alırlar. Örneğin çoğu zaman protein yapıda olan enzimler olmasaydı, canlılık da mümkün olmazdı.
Her ne kadar enzimatik proteinler defalarca kullanılabilir olsalar da, kendine özgü yapı ve işleve sahip on binlerce diğer protein, metabolik aktivitelerin gerçekleşmesinde ve düzenlenmesinde aktif bir şekilde görev alır; bu proteinler zaman içinde tüketilir ve yeniden üretilir.
Proteinlerin çok çeşitte görevler üstlenmelerinden dolayı, yapıları da oldukça farklıdır. Her protein türü, kendine özgü 3 boyutlu yapıya sahiptir. Bir proteini bir diğer proteinden ayıran temel şey, amino asitlerin dizilimidir - ki bu dizilim de o amino asit dizisini kodlayan genetik dizilim tarafından dikte edilir. Proteinler, ayrıca nasıl katlandıklarına (yani 3 boyutlu yapılarının ne olduğuna) bağlı olarak da birbirlerinden ayırt edilebilirler.
Proteinlerin Yapı Taşı: Amino Asit Nedir?
Proteinler, amino asit denen 20 farklı çeşidi bulunan amino asitlerin farklı kombinasyonlarda, uç uca, üst üste, yan yana peptit bağı adı verilen bir bağ türüyle bağlanması sonucu oluşan, polimer olarak bilinen bir molekül kompleksidir. Peptit bağı, amino asitlerin su kaybetmesi (dehidrasyonu) ile oluşan, kovalent yapılı bir bağdır.
Amino asitler ile proteinler arasında "ara geçiş kimyasalları" olarak görebileceğimiz, peptit isimli kimyasallar da bulunur. Bunlar, ne protein olan ne de tek başına amino asit olan, polimer varyantlarıdır. Bunları kullanarak, kimyasal evrim sürecinde birikimli seçilimi sonucunda veya hücre içi biyokimyasal yolaklar sayesinde daha karmaşık proteinler inşa edilebilir. Hatta peptitlerle proteinler arasında da boyları genelde 100 amino aside kadar olan polipeptitler vardır. Yani evrimsel süreçte görmeyi beklediğimiz üzere, kimyasal evrimde de en basit yapılı amino asitlerle en karmaşık yapılı proteinler arasında kademeli ve yumuşak bir geçiş (ara basamaklar) bulmak mümkündür.
Amino Asitlerin Yapısı
Organizmalarda en çok bulunan organik biyomolekül olan proteinler, diğer yaygın biyomoleküllerden (örneğin karbonhidrat ve lipitlerden) farklı olarak; karbon, hidrojen ve oksijene ilaveten azot, fosfor ve kükürt elementlerini de içerirler.
Amino asit dediğimiz yapı, "amino" grubu ile "karboksil" grubu adı verilen iki kimyasal grubun bağlanmasıyla oluşur. Amino (veya İng: "amine"), "azot içeren" demektir; karboksil ise "karbon içeren" demektir. Aşağıda günümüze kadar süren evrimsel süreçte oluşmuş 20 temel amino asidi ve bunların kimyasal yapısını görmektesiniz:
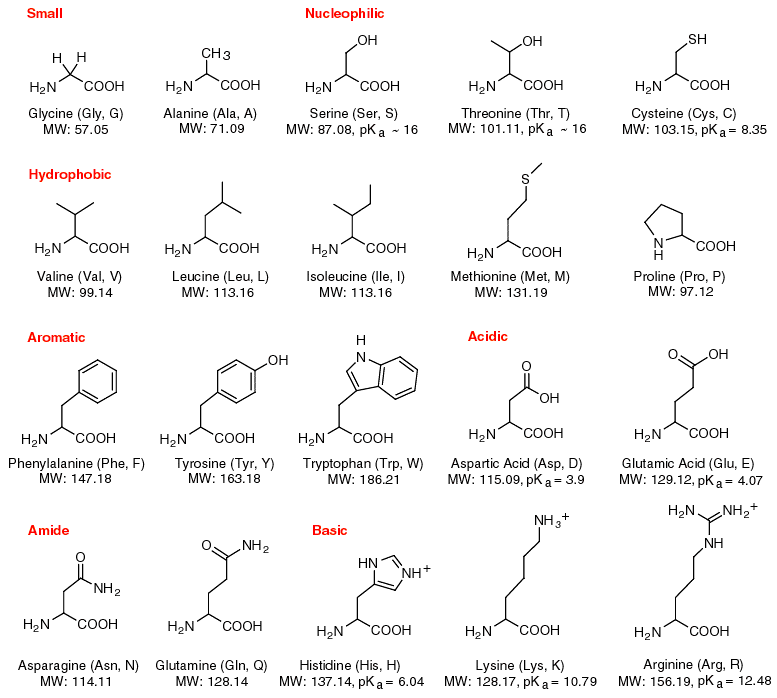
Burada gösterilenler, canlılığın yapıtaşları arasında olduğu bilinen 20 amino asittir. Ancak canlılığın yapısına katılmayanları da sayacak olursak, 300'den fazla amino asit olduğu bilinmektedir.
Her bir amino asit, bir karbon atomu (α karbon olarak adlandırılır), bu karbon atomunun bağlı olduğu bir karboksil (COO-) grubu, bir amino grubu (NH3+), bir hidrojen atomu ve belirli bir "yan grup" içermektedir. "Değişiken grup" olarak da bilinen bu yan grup, amino asitin spesifik kimyasal özelliklerini belirler ve her bir amino asitin proteinin yapı ve işlevlerindeki rolünü saptar.
/old/content_media/26bb8cf73074e6d1a8076e63d3c0b21c.jpg)
Görselden görülebileceği üzere, bir amino asidin de yapısında, diğer moleküllerden farklı bir özellik yoktur. Tek gördüğümüz; karbonlar, oksijenler, hidrojenler ve azottur! Amino asitlerin içerisinde hem asidik, hem bazik özellikte parçalar bulunduğu için, organizmaların asit-baz dengesini sağlamasında çok avantajlı bir moleküldür.
Aslında maddi destek istememizin nedeni çok basit: Çünkü Evrim Ağacı, bizim tek mesleğimiz, tek gelir kaynağımız. Birçoklarının aksine bizler, sosyal medyada gördüğünüz makale ve videolarımızı hobi olarak, mesleğimizden arta kalan zamanlarda yapmıyoruz. Dolayısıyla bu işi sürdürebilmek için gelir elde etmemiz gerekiyor.
Bunda elbette ki hiçbir sakınca yok; kimin, ne şartlar altında yayın yapmayı seçtiği büyük oranda bir tercih meselesi. Ne var ki biz, eğer ana mesleklerimizi icra edecek olursak (yani kendi mesleğimiz doğrultusunda bir iş sahibi olursak) Evrim Ağacı'na zaman ayıramayacağımızı, ayakta tutamayacağımızı biliyoruz. Çünkü az sonra detaylarını vereceğimiz üzere, Evrim Ağacı sosyal medyada denk geldiğiniz makale ve videolardan çok daha büyük, kapsamlı ve aşırı zaman alan bir bilim platformu projesi. Bu nedenle bizler, meslek olarak Evrim Ağacı'nı seçtik.
Eğer hem Evrim Ağacı'ndan hayatımızı idame ettirecek, mesleklerimizi bırakmayı en azından kısmen meşrulaştıracak ve mantıklı kılacak kadar bir gelir kaynağı elde edemezsek, mecburen Evrim Ağacı'nı bırakıp, kendi mesleklerimize döneceğiz. Ama bunu istemiyoruz ve bu nedenle didiniyoruz.
Amino asit şemalarında yaygın olarak gösterilen "R" harfi, "radikal" kelimesinin ilk harfidir. Bu harf, değişken uzunlukta ve yapıda bir kimyasal grubu ifade etmektedir; buna yan zincir veya R-grubu denmektedir. Molekülün bu kısmına da çeşitli atomlar bağlanarak, birbirinden farklı amino asitleri oluştururlar. Bu grubun esnekliği, amino asit çeşitliliğinin kökeninde yatan kimyasal kaynaktır; çünkü bu parça farklı boyutlarda olabilir, polar veya apolar olabilir ve tüm bu nitelikleri sayesinde amino asitlere bambaşka özellikler kazandırabilir. Örneğin sistein ve metiyonin isimli iki amino asitte bu yan zincir, sülfür de içermektedir. Sülfür, hidrojen bağlarına katılmaz; ancak diğer tüm amino asitlerde hidrojen bağları vardır ve sadece bu basit varyasyon bile, bu iki amino asidi içeren proteinlerin yapısını köklü bir şekilde değiştirebilir. Yani amino asitlerde gördüğümüz bu geniş çeşitlilik, kimyasal evrim ve canlılığın başlangıcı açısından büyük öneme sahiptir.
Amino Asit Çeşitleri ve Amino Asitlerin Sınıflandırılması
Az önce de söylediğimiz gibi, bugüne kadar 300 kadar farklı amino asit çeşidi tanımlanmış olsa da, bunlardan yalnızca 20 tanesi genetik kodun okunması ile protein sentezine girerler. Bitki ve bakteriler, bu 20 amino asidin tamamını sentezleyebilirler. İnsanlar gibi birçok hayvan türüyse, bu amino asitlerin sadece bir kısmını sentezleyebilirler.
/old/content_media/9Nf98Fs3qKetVLbrDyieYPFhcseoi1Vn.jpeg)
Esansiyel ve Nonesansiyel Amino Asitler
Bu 20 amino asitin yalnızca 12 tanesi insanlar tarafından üretilebilir ve bunlara temel olmayan (nonesansiyel veya zorunlu olmayan) amino asit adı verilmektedir. Geriye kalan 8 amino asidi ise diyetle vücuda alınmak zorundadır. Vücutta üretilmeyen ve hazır olarak alınması zorunlu olan amino asitlere temel (esansiyel veya zorunlu) amino asitler denir.
Bu "temel olma" durumu zamana ve mekana bağlı olarak değişebilir: Örneğin histidin ve arjinin amino asidi genç bireylerde esansiyel iken, yetişkin bireylerde nonesansiyel amino asitlerdir. Tirozin amino asidi ise vücutta fenilalanin amino asidi varlığında üretilebilmektedir.
/old/content_media/a275be21682edd2eca6c1b4d566eb25e.jpg)
Hidrofobik ve Hidrofilik Amino Asitler
Amino asitler, yan gruplarının özelliklerine göre, dört geniş sınıf oluştururlar. 10 amino asit, su ile etkileşime girmeyen nonpolar yan zincirler içerirler. Glisin, yan grubu yalnızca bir hidrojen atomundan ibaret olan, en basit amino asittir.
Alanin, valin, lösin ve izolösin de, dört karbon atomuna kadar hidrokarbon zinciri bulunmaktadır. Bu amino asitlerin yan grupları hidrofobik olup, proteinlerin, su ile temas etmeyecekleri iç bölgelerinde yer alma eğilimindedirler. Benzer şekilde iki nonpolar ( polar olmayan ) amino asit, fenilalanin ve triptofan, kuvvetli hidrofobik aromatik halkalar içeren yan gruplara sahiptir.
Prolin de benzer olarak bir hidrokarbon zinciri içerir; ancak, yan zinciri amino grubun azotuna ve α karbona bağlı olup halkasal bir yapı oluşturan tek amino asit olma özelliğindedir. İki amino asit, sistein ve metiyonin, yan zirleri kükürt atomu içermektedir. Metiyonin oldukça hidrofobiktir; ancak, sistein, sülfidril (SH) grubu nedeniyle, daha az hidrofobdur. Sisteinin sülfidril grubu, değişik sistein birimlerinin yan grupları arasında disülfid bağları oluşabildiği için, protein yapısında önemli bir görev üstlenmektedir.
5 adet amino asit yüksüz fakat polar yan zincirler içerirler. Bunlar, yan zincirlerinde hidroksil grupları içeren serin, treonin, tirozin ile polar amid grupları (O=C−NH2\text{O}=\text{C}-\text{NH}_2) içeren asparajin ve glutaminden oluşmaktadır. Bu amino asitlerin polar yan zincirleri su ile hidrojen bağı oluşturabildiklerinden, bu amino asitler hidrofilik özellikte olup proteinlerin dış yüzeylerinden yerleşme eğilimi göstermektedirler.
Lizin, arginin ve histidin amino asitleri yüklü bazik yan zincirler içerirler. Lizin ve arjinin bazik özellikte amino asitlerdir ve yan zincirleri hücre içinde pozitif yüklüdür. Dolayısıyla, kuvvetli hidrofilik özellikte olup proteinlerin yüzeylerinde su ile temas halinde bulunurlar. Histidin, fizyolojik pH'da yüksüz ya da pozitif yüklü olarak bulunur, böylece hidrojen iyonlarının değişimini kapsayan enzimatik tepkimelerde aktif rol oynarlar.
Aspartik asit ve glutamik asit, karboksil gruplarla sonlanan asidik yan zincirler taşırlar. Bu amino asitler hücre içinde negatif yüklü olup sıklıkla, aspartat ve glutamat olarak adlandırılırlar. Bazik amino asitler gibi bunlar da kuvvetli hidrofiliklerdir ve genellikle proteinlerin yüzeylerinde yerleşim gösterirler.
Amino Asitler Nasıl Evrimleşti?
Peki proteinleri oluşturan amino asitler, kendilerinden önce gelen inorganik moleküllerden nasıl oluşmuş olabilir?
Her ne kadar amino asitlerin kimyasal tepkimelerle, dolayısıyla kendiliğinden oluşabileceklerini ispatlayan deneyler 19. yüzyılın başlarına, Alman kimyager Friedrich Wöhler'e kadar dayansa da; başarılı bir biçimde, laboratuvar ortamında ilk defa 1850 senesinde Adolphe Strecker tarafından bir amino asit üretilmiştir. Strecker, yine okyanus tabalarında bulunduğunu bildiğimiz (o zamanlarda bu bilinmiyordu) asetaldehit, formladehit, amonyak ve hidrojen siyanit kullanarak alanin ve glisin isimli bir amino asitleri doğal yollarla sentezlemeyi başarmıştır. Bugün bu tepkimeler Strecker Sentezi olarak bilinmektedir (aşağıda gösterilmiştir). Günümüzde bu tepkime ve benzerlerinin okyanus tabanlarındaki volkan bacaları etrafında, kendiliğinden olduğunu ve amino asitleri oluşturduğunu biliyoruz.
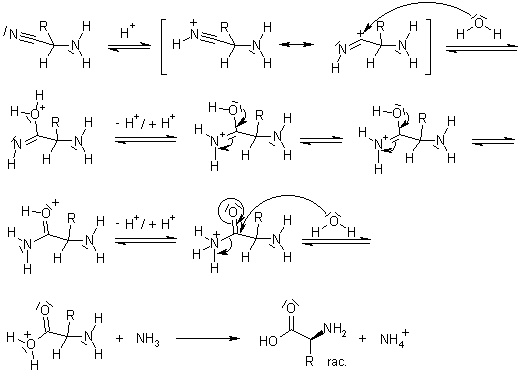
Sadece bu da değil. 1913 yılında Walther Löb ve Oskar Baudish potasyum siyanür ve formaldehit kullanarak, mor ötesi ışınlar ve elektrik etkisi altında glisini üretmeyi başardı. Hatta sonradan, ilkel atmosferik koşullarda karbonmonoksit ve amonyak gazlarının elektrik yükü altında tepkimesiyle de formamidinin sentezlenebileceğini ispatladılar.
/evrimagaci.org/public/images/dyn/a3e40ec0b61f2d9ae697f79f6221c91d.png)
Günümüzde, canlılığın başlangıcı için gereken tüm kimyasalların su içerisinde oluşmadığını ve atmosferde de birçok kimyasalın oluştuğunu biliyoruz. Daha sonradan okyanuslar üzerine yağmurlarla veya başka yollarla çöken bu kimyasallar, okyanus tabanlarında birikmeye başlamış ve canlılığın yapısına katılmıştır. Dolayısıyla canlılığın başlangıcını sadece okyanus tabanlarıyla sınırlı tutmak doğru olmayacaktır. Bunlara daha sonradan geleceğiz.
Amino asitlerin doğal süreçlerle oluşabileceği konusuna odaklanan tek bilim insanları bunlar değildir. Yüzlerce biyokimyager bu konuda uzmanlaşarak canlılığın sırlarını çözmeye çalışmışlardır. Bunlardan en meşhur olanları şüphesiz öncelikle Alexander Oparin, sonrasında ise Stanley Miller ile Harold Urey'dir. 1953 yılında ilk defa yapılan Miller-Urey Deneyi, günümüzde halen yankılarını sürdürmektedir. O dönemden sonra yapılan 460'tan fazla denemede, sadece tüm amino asitler değil, Hayat Molekülleri'nin neredeyse tamamı laboratuvar koşullarında elde edilebilmiştir.
Bu deneyi ve detaylarını bir başka yazımıza sakladığımız için, burada detaylarına pek girmeyeceğiz. Ancak ilk yapılan ve temel bazı hataları bulunan (sonradan diğer deneylerde düzeltilmiştir) Miller-Urey Deneyi'nde üretilen yapılar şunlardır:
- Karboksisilik Asitler
- Formik asit
- Asetik asit
- Propiyonik asit
- Düz ve dallı yağ asitleri (C4-C10)
- Glikolik asit
- Laktik asit
- Susinik asit
- Nükleik Asit Bazları
- Adenin
- Guanin
- Ksantin
- Hipoksantin
- Sitozin
- Urasil
- Amino Asitler
- Glisin
- Alanin
- α\alpha-aminobütrik asit
- Valin
- Lösin
- İzolösin
- Prolin
- Aspartik asit
- Glutamik asit
- Serin
- Treyonin
- Şekerler
- Düz ve dallı pentozlar ve hekzozlar
Üstelik tüm bunların oluşumu sadece 6 gün sürmüştür! 2012 yılında Harold Urey'in laboratuvarında sakladığı bazı deney tüpleri açığa çıkarılmıştır. Yapılan analizlerde, 1953 senesinden bu yana bekleyen tüplerde tüm amino asitlerin, şekerlerin tamamının, nükleik asitlerin ve canlılığın yapısına doğrudan katılmayan birçok organik molekülün kendiliğinden oluştuğu görülmüştür. Tahmin edilebileceği gibi bu deneylerde zaman arttıkça, ürünler de artmaktadır. Unutmayınız ki yapılan deneyler, yaklaşık 400-600 milyon yılda oluşan canlılığın temellerini, sadece birkaç gün ve haftada elde etmeyi hedeflemektedir. Buna rağmen, çok başarılı sonuçlar elde edebilmektedirler!
Daha sonradan yapılan deneylerde, amino asitlerin doğal süreçlerle bir araya gelerek proteinleri oluşturabileceği de ispatlanmıştır. Örneğin Sidney Fox'un yaptığı deneylerde 150oC sıcaklıkta 15 gün kadar bir süre içerisinde 23 amino asit uzunluğunda proteinlerin oluştuğunu gözledi. Fox, bu deneylerinde sodyum klorür, bikarbonat, aspartik asit, glutamik asit, karbonik asit, amonyum klorür gibi kimyasallar kullanmıştır. Kendisinden sonra yapılan deneyler de, Fox'un çalışmalarını doğrulamış ve hatta daha uzun yapılı proteinlerin de birkaç haftada kendiliğinden oluşabileceğini ispatlamıştır.
Amino Asitlerin Birleşmesi ve Proteinlerin Oluşumu
Protein sentezi sırasında, bir amino asidin karboksil grubu ile diğer bir amino asidin amino grubu reaksiyona girer. Bu reaksiyon sonucu su açığa çıkar (dehidrasyon tepkimesi) ve peptid bağı oluşur. Peptid bağının oluşumu monosakkaritlerin polimerleşmesini çağrıştırır; ama ondan çok farklıdır. Bu farklılık, amino asitlerin birbirine bağlanmasının ribozom adı verilen organeller aracılığıyla olması ve bu olayda çok sayıda enzim ve ara bileşiklerin işlev görmesinden kaynaklanmaktadır.
Bu 20 amino asitten bir kısmını içeren sadece 20 amino asitlik zincir, bildiğimiz en küçük protein olan TRP-Cage proteinini oluşturabilirken, aynı 20 amino asitten yüzlercesi ve binlercesi bir araya gelerek, hücrelerimizde bulunan devasa proteinleri oluşturabilirler. Örneğin vücudumuzda bulunan 27.000-33.000 amino asitli titin proteini, bildiğimiz en büyük proteinlerden birisidir; ancak canlılardaki amino asitlerin çoğu, genellikle birkaç on ila birkaç yüz amino asidin bir araya gelmesiyle oluşur. Yani aynı amino asitler, farklı şekillerde bir araya gelerek, inanılmaz bir protein çeşitliliği oluşturmaktadır. Bu çeşitlilik, yaşamın çeşitliliğin özüdür! Örneğin aşağıda bir G-Proteini görüyorsunuz:
/evrimagaci.org/public/uploads/images/Makaleler/1b9x_opm.png)
Bu protein yapısında yüzlerce amino asit, farklı sıra ve sayılarda kullanılmaktadır (yukarıdaki temsili bir 3 boyutlu çizimdir, dolayısıyla amino asitler ayrı ayrı gözükmemektedir). Bu sıraların ve sayıların değişmesi, farklı özelliklerde proteinlerin üretilmesi, bu da farklı protein moleküllerinin farklı işlevlere sahip olabilmesi demektir. Bunu, Türkçede bir cümle oluşturmaya benzetebilirsiniz. Bu benzetimle ilgili detaylı bir yazımızı buraya tıklayarak okuyabilirsiniz.
Proteinler Neden Bu Kadar Çeşitlidir?
Proteinlerin şekilleri, onların nasıl çalışacağını doğrudan belirler. Yani proteinleri adeta bir "alet" gibi düşünebilirsiniz. Nasıl ki bir çorba içmek için çatal, bir biftek yemek için kaşık kullanamazsınız (veya kullansanız da pek iyi çalışmaz), proteinlerin de şekilleri, onların neler yapmakta kullanılabileceğini belirler. Bu nedenle proteinlerin şekil ve yapı çeşitliliği büyük öneme sahiptir.
Proteinler de amino asitler gibi büyük ya da küçük, hidrofilik ya da (çoğunlukla olduğu gibi) hidrofobik olabilir, tek başına ya da çok birimli bir yapının parçası olarak da bulunabilir ve sık sık şekil değiştirebilir ya da neredeyse sabit/değişmez kalabilir. Tüm bu farklılıklar, proteinleri oluşturan benzersiz amino asit dizilerinden kaynaklanmaktadır. Proteinlerin 3 boyutta katlanış biçimleri de hangi diğer moleküllerle etkileşime girdiklerini etkileyen farklı yüzey özelliklerine sahiptir. Proteinler diğer moleküllerle bağlandığında, yapıları az veya çok miktarda değişebilir.
/old/content_media/2990c445a17972f7436c85ac857a5004.jpg)
Şaşırtıcı olmayan bir şekilde, protein fonksiyonları da protein yapıları kadar çeşitlidir. Örneğin, yapısal proteinler, bir iskelete benzer şekilde hücre şeklini korur ve omurgalılarda kıkırdak ve kemik gibi bağ dokularında yapısal elementler oluştururlar. Enzimler başka bir protein türüdür ve bu moleküller hücrelerde meydana gelen biyokimyasal reaksiyonları katalize eder. Yine diğer proteinler, hücre dışından gelen metabolik sinyallere veya mesajlara yanıt olarak şekillerini ve aktivitelerini değiştirerek düzenleyici görevi görürler. Hücreler ayrıca hücre dışı matrisin bir parçası olan veya hücreler arası iletişimde yer alan çeşitli proteinler salgılar.
Proteinler bazen translasyon (protein üretimi) ve katlama işlemleri tamamlandıktan sonra değiştirilir. Bu gibi durumlarda, transferaz enzimleri, proteine fosfatlar veya karboksil grupları gibi küçük değiştirici gruplar ekler. Bu modifikasyonlar genellikle protein konformasyonunu değiştirir ve bir proteinin aktivitesini açıp kapatan moleküler anahtarlar gibi davranır. Farklı enzimler ters reaksiyonları katalize etse de, birçok translasyon sonrası modifikasyon geri dönüşümlüdür. Örneğin, kinaz adı verilen enzimler proteinlere fosfat grupları ekler; ancak bu fosfat gruplarını uzaklaştırmak için fosfataz adı verilen başka enzimler gereklidir.
/old/content_media/14465b1c37ab7f0cb36c19e0dcbb9811.jpg)
Proteinin İşlevleri
Proteinler, temel olarak her yerde kullanılabilen, çok önemli, son derece istikrarlı (stabil) moleküllerdir. Proteinlerin hücre içinde çok çeşitli görevleri vardır. Proteinler, hücre şekli ve iç organizasyonu, ürün üretimi ve atık temizliği ve rutin bakım dahil olmak üzere, hücresel yaşamın neredeyse her görevinden sorumludur. Proteinler ayrıca hücre dışından sinyaller alır ve hücre içi yanıtı harekete geçirir.
En önemli görevleri arasındaysa enzimleri oluşturmak ve diğer tepkimelerin hızlarını kat be kat arttırmak bulunur. Çünkü doğadaki birçok kimyasal tepkime oldukça yavaştır; ancak ortamda enzimlerin veya katalizörlerin bulunması halinde bu tepkimeler çok daha hızlı gerçekleşebilir. Eğer vücudumuzda protein yapılı enzimler bulunmasaydı, vücudumuzun şu andaki şekliyle işlemesi mümkün olmazdı (tabii bu tür kimyasal ön koşullar altında, bambaşka yapıların evrimleşebileceği de iddia edilebilir).
Proteinlerin işlevlerine genel olarak bir bakış atalım.
Enzim Proteinleri
Hücreler, metabolik reaksiyonları katalize etmek için binlerce farklı enzime ihtiyaç duyar. Enzimler protein yapıdadır ve reaksiyonun aktivasyon enerjisini düşürerek bir biyokimyasal reaksiyonun ilerlemesini daha kolay hale getirirler, böylece bu reaksiyonların katalizör olmadan olduğundan binlerce hatta milyonlarca kat daha hızlı ilerlemesini sağlarlar.
Protein yapılı enzimlerde asıl iş, enzimin aktif bölge adı verilen kısmında gerçekleşir. Her enzim, çok kısıtlı sayıda (neredeyse her zaman 1 adet) tepkimeyi hızlandırabilir; çünkü az önce de söylediğimiz gibi proteinlerin yapısındaki her türlü değişim, onların fonksiyonunu da az çok etkilemektedir. Buna, enzim spesifitesi adı verilir. Bu özellik çerçevesinde, sadece belirli bir şekle ve elektrik yüküne sahip olan kimyasallar enzim ile bağ kurabilir.
Bir enzimin, hızlandıracağı kimyasal tepkimede bağlandığı maddeye substrat adı verilir. Bu ikili birbirine bağlandığında, enzim-substrat kompleksi üretilmiş olur. Enzim ve spesifik olduğu substrat arasında, anahtar-kilit ilişkisi denen bir uyum vardır. Enzimler, bir veya daha fazla substrata bağlanarak, bir reaksiyonun gerçekleşmesi için bir araya getirmek ve reaksiyon tamamlandıktan sonra serbest kalacak şekilde çalışırlar (tıpkı bir anahtarın, uyduğu kilidi açtıktan sonra tekrar tekrar kullanılabilmesi gibi). Özellikle, substrat bağlanması meydana geldiğinde, enzimler substratları daha reaktif olacak şekilde yönlendiren veya zorlayan bir konformasyonel değişime uğrarlar.
Anlayacağınız, enzimler, "sihirli moleküller" değildir; en nihayetinde, diğer kimyasal maddelerin oryantasyonunu (duruş yönünü) ve kimi zaman fiziksel yapısını (konformasyonunu) değiştiren moleküllerdir. Bir enzim, bir substratı, kimyasal tepkimeye daha açık hale getirir; bu sayede normalde o kimyasal madde daha yavaş tepkime geçirirken, enzim varlığında daha hızlı bir şekilde tepkimeye girebilir. Tepkime sonrasında enzim, yapısı değişen substrata bağlanamaz ve enzim-substrat kompleksi dağılır. Böylece o enzim, bir diğer substrata bağlanmak üzere boşa çıkmış olur ve bu sayede enzimler, substrat var olduğu sürece, neredeyse durmaksızın kimyasal tepkimeleri hızlandırmaya devam edebilirler.
Bu açıdan, enzimatik görevi olan proteinler ilk defa evrimleştikten sonra, kimyasal evrimin ne kadar büyük bir hız kazandığı da anlaşılır olacaktır. Bu noktada, tepkimeleri hızlandıran tek unsurun enzimler olmadığını, kimi zaman basit inorganik katalizörlerin de kimyasal tepkimeleri hızlandırabildiği hatırlanmalıdır. Bu katalizörlerin etkisi altında amino asitler ve proteinler evrimleşmiş, bu proteinlerin faaliyetleri sayesinde diğer kimyasal süreçler hızlanarak, evrime hız katmıştır.
Bir enzimin adı genellikle katalize ettiği biyokimyasal reaksiyonun tipini ifade eder. Örneğin, proteazlar proteinleri parçalar ve dehidrogenazlar, hidrojen atomlarını uzaklaştırarak bir substratı oksitler. Genel bir kural olarak, "-ase" (veya Türkçe isimlerde "-ez" veya "-az") soneki bir proteini enzim olarak tanımlarken, bir enzimin adının ilk kısmı katalize ettiği reaksiyonu ifade eder.
/old/content_media/611efc77bccaba09c56124e1163fe603.jpg)
Yapısal Proteinler
Ancak proteinlerin tek görevi enzimatik faaliyet değildir. Vücudumuzdaki neredeyse her işlev, proteinler sayesinde yapılır. Çünkü genetik kodlarımız, proteinlerin üretimini kodlamaktadır ve bu sayede aklınıza gelebilecek her özelliğimizi kazanırız. Ayrıca proteinler, hücrelerin yapısına da katılarak önemli iletişim ve yapı görevleri üstlenebilirler.
Örneğin hücre içi sıvısı olarak bilinen sitoplazma, proteinler sayesinde yapısını kazanır. Özellikle prokaryotik hücrelerden daha büyük olma eğiliminde olan ve daha fazla mekanik desteğe ihtiyaç duyan ökaryotik hücrelerde, geniş bir filament ağı - mikrotübüller, aktin filamentleri ve ara filamentler - çeşitli mikroskobik yöntemlerle tespit edilebilir. Mikrotübüller sitoplazmanın düzenlenmesinde ve organellerin dağılımında önemli bir rol oynar. Ayrıca hücre bölünmesi sırasında mitotik iğ ipliklerini oluştururlar. Aktin filamentleri, hücre hareketi, kas hücrelerinin kasılması ve hücre bölünmesi dahil olmak üzere çeşitli hücre hareketi formlarında yer alır. Ara filamentler, hücrelerin içinde mimari destek görevi gören güçlü liflerdir.
/old/content_media/3a15a5b6ba1ada299b4def22763c7cff.jpg)
Buna ek olarak proteinler, organlarınızın inşasında da kullanılır. Örneğin derinizin üst tabakasındaki keratin yapısı, proteinlerden inşa edilir. Derinizin dermis tabakasındaki, kemiklerinizdeki ve beyninizin menenj adı verilen zarındaki kolajen, proteinlerden inşa edilir. Sindirim kanalımızdaki sindirim enzimleri, savunma sisteminizdeki antikorlar, sinir sisteminizdeki nörotransmiterler, hormonal sisteminizdeki hormonların önemli bir bölümü, peptit-temelli proteinlerdir. Tüm bunlar, amino asitlerin farklı kombinasyonlarından ötürü proteinlerin de farklı özelliklerde olabilmesinin bir sonucudur. Bu sebeple canlılığı, "proteinlerin işlevlerinin bir toplamı" olarak görmek çok da isabetsiz bir düşünce olmayacaktır.
Plazma Proteinleri
Plazma zarındaki proteinler tipik olarak hücrenin çevresiyle etkileşime girmesine yardımcı olur. Örneğin, plazma zarı proteinleri, besin maddelerinin plazma zarı boyunca taşınması, hücre dışından kimyasal sinyaller alınması, kimyasal sinyallerin hücre içi harekete dönüştürülmesi ve bazen hücrenin belirli bir yere sabitlenmesi gibi çeşitli işlevleri yerine getirir.
Transmembran proteinlerinden olan taşıyıcı proteinler, plazma zarının bir tarafından diğerine bir molekül (glikoz gibi) taşır. Reseptörler, hücre dışı bir molekülü (üçgen) bağlayabilir ve bu, hücre içi bir süreci aktive eder. Zardaki enzimler, bir hücrenin sitoplazmasında yaptıklarının aynısını yapabilirler; bir molekülü başka bir forma dönüştürmek gibi. "Mızrak" veya "çapa" (İng: "spike") proteinleri, hücre içi yapıları hücre dışı yapılarla fiziksel olarak bağlayabilir.
/old/content_media/a73df5afef182d00f68abee28f3c7c82.jpg)
Membran proteinlerinin genel yüzeyleri, proteinlerin membran çift tabakasındaki lipidlerle temas ettiği hidrofobik amino asit yüzeyleri ve su bazlı sitoplazmaya uzanan yüzeylerde hidrofilik amino asit yüzeyleri olan mozaiklerdir. Birçok protein, zar difüzyonu adı verilen bir süreçle plazma zarı içinde hareket edebilir. Zar içinde hareket edebilen bu zara bağlı protein kavramına hücre zarının sıvı-mozaik modeli denir. Lipid çift tabakasının ötesinde hücre dışı ortama uzanan zar proteinlerinin kısımları da hidrofiliktir ve sıklıkla şeker moleküllerinin eklenmesiyle değiştirilir. Diğer proteinler zarla ilişkilidir; ancak içine yerleştirilmemiştir. Bazen zardaki lipidlere bağlanırlar veya diğer zar proteinlerine bağlanırlar.
/old/content_media/2eb49493dc9578e44cc9d45ec404692f.jpg)
Proteinler, hücreler içinde çeşitli işlevlere hizmet eder. Temel olarak bu görevleri ile proteinleri; enzim, savunma, depo, taşıyıcı, hormonal, reseptör, kasılma-motor ve yapısal proteinler olarak ayırabiliriz. Tek tek proteinlerin işlevleri, benzersiz amino asit dizileri ve karmaşık üç boyutlu fiziksel yapıları kadar çeşitlidir.
Proteinlerin Yapısı, İşlevi Nasıl Etkiler?
Proteinlerin özgül işlevleri, onların üç boyutlu yapılarından kaynaklanmaktadır. Bu yapılarının en basit düzeyi amino asit dizileridir.
Daha önceden sözünü ettiğimiz polipeptid ile protein aynı şey değillerdir. Tabii tek bir polipeptidden oluşmuş olan bir protein için ikisi aynı şey; ancak bu iki terim arasındaki ilişkiyi, uzun bir yün ipliği ile bu yünden örülen belirli bir giysinin sadece kol kısmı ile (bu "polipeptid" olacaktır), o yün iplikle örülen kazağı (bu "protein" olacaktır) örnek olarak verebiliriz. İşlevsel bir protein sadece bir polipeptid zinciri olmayıp, çok özel bir şekilde bükülüp, kıvrılıp özgün biçim kazanmış bir ya da birkaç polipeptidden oluşan bir moleküldür.
Hücre bir polipeptid sentezi yaptığı zaman, bu zincir, zinciri oluşturan atomların sahip olduğu elektromanyetik özelliklerin etkisi altında kendiliğinden kıvrılarak, proteinin işlevsel yapısını kazandırır. Bu katlanma, amino asit dizileri tarafından belirlenen, çeşitli bağlar kurulmasıyla sürdürülür ve desteklenir.
Bir proteinin özgül yapısı, onun hangi işlevi göreceğini belirler. Neredeyse her durumda bir proteinin işlevi, bir başka molekülü tanıyarak onu bağlanma yeteneğine dayanır. Buna verilebilecek en iyi örnek, antikor (vücuttaki bir protein) ile bu antikorun bağlanarak parçalanmak üzere işaretlediği grip virüsü verilebilir.
/old/content_media/0d288a87ee0403b8daf346a99e6c5a1d.png)
Yukarıdaki resimde görülen bu uyum, anahtar-kilit örneğindeki gibi son derece özgüldür. Dolayısıyla bir proteinin işlevi, moleküler düzeninin sonucu olarak ortaya çıkan bir özelliktir.
Protein Yapısını Oluşturan Dört Düzey
Bir proteinin işlevini anlayabilmek için, onun yapısını bilmek şarttır. Protein çeşitliliği çok fazla olmakla beraber, tüm proteinler birincil, ikincil ve üçüncül yapı olarak bilinen üst üste çakışmış üç yapısal düzeyi paylaşırlar. Bu üç yapıdan ayrı olan dördüncül yapı, iki ya da daha fazla sayıda polipeptid zinciri içeren proteinlerde ortaya çıkmaktadır.
/old/content_media/2a9c4e5b61e61bdc42c18473080354dd.jpg)
Proteinleri oluşturan amino asitlerin bir araya gelmesiyle birincil yapı dediğimiz polipeptit zincirleri oluşur. Birincil yapıyı bir arada tutan, kovalent bağlardır. Bu zincir, kendi üzerine farklı şekillerde katlanarak alfa-heliks veya beta-katlanmış plaka adı verilen, ikincil yapı olarak da bilinen şekilleri oluştururlar. Bu ikincil yapı, amino asitler arasındaki hidrojen bağlarıyla bir arad tutulur. İri proteinlerin bu katlı şekli, tekrar kendi üzerine katlanarak üçüncül yapı dediğimiz bir şekli oluştururlar. Hatta bazı proteinler öylesine iridir ki, kendilerini oluşturan amino asit gruplarını "alt birim" olarak bilinen parçalara bölmemiz mümkündür ve bu parçaların birbiriyle etkileşimi, dördüncül yapı adını verdiğimiz, protein fonksiyonlarını doğrudan etkileyen bir yapıyı oluşturur.
Şimdi bunları biraz daha yakından tanıyalım:
Birincil Yapı
Özgül diziler ile birbirine bağlanmış olan amino asitler proteinlerin birincil yapısını oluşturur. Her amino asit özgün bir R grubuna sahip olduğu için, amino asitlerin dizilişi R gruplarının belirli bir şekilde sıralanmasına neden olur. Bu R grupları kimyasal olarak farklı oldukları için proteinler de son derece karmaşık özelliklere sahip olur. Proteinler esnek yapıdadır, aynı proteinin bazı bölgeleri diğer bazı bölgeleri ile etkileşerek bütün bir protein molekülünün karakteristik bir şekle sahip olmasına yol açar.
Bir proteinin birincil yapısı, amino asitlerin rastgele olarak bağlanmasına değil, kalıtsal genetik bilgi tarafından belirlenir. Bu birincil yapı, zincir boyunca yerleşmiş R gruplarının ve omurganın kimyasal niteliğine bağlı olarak ikincil ve üçüncül yapıyı tayin eder.
İkincil Yapı
Proteinlerin genel biçiminin belirlenmesi, zincirde tekrarlanan kıvrım ya da katlanmalar şeklinde olur. Tümü bir arada ikincil yapı olarak ifade edilir. İkincil yapı, polipeptid omurgasının tekrarlanan bileşenleri arasındaki hidrojen bağlarının bir sonucu olarak ortaya çıkar. Omurga içindeki oksijen atomları kısmi negatif yüke sahip iken, azotlara bağlı hidrojen atomları ise kısmi pozitif yük taşırlar ve böylece bu atomlar arasında hidrojen bağları kurulabilir. Hidrojen bağları tek başına oldukça zayıf olmakla birlikte, polipeptid zincirinin nispeten uzun bir bölgesinde birçok kez tekrar edildiklerinden dolayı proteinin bu kısmını belirli bir şekilde tutabilirler.
İkincil yapı içerisinde iki farklı yapıya ayrılır. Bunlardan biri olan alfa heliks, polipeptid zincirinin bir bölgesi kendi çevresinden döndüğünde , bir peptid bağının CO grubu ile, doğrusal polipeptid zincirinde dört adet amino asit birimi uzaklığında diğer bir peptid bağının NH grubu arasında bir hidrojen bağının oluşumu ile şekillenmektedir. Bazı proteinler tek alfa heliks yapısına sahip iken, bazıları örneğin globüler proteinler heliks yapısında olmayan bölgelerde birbirinden ayrılmış birden fazla alfa helikse sahiptir. Saçın yapısal proteini olan alfa keratin gibi bazı fibröz proteinler tamamen alfa heliks yapıdadır.
Diğer yandan beta pilili tabakası bir polipeptid zincirinin iki bölümü, aralarında hidrojen bağları ile, yan yana dizildiğinde şekillenmektedir. Bu tür beta pilili tabakalar, birbirine paralel ya da antiparalel olarak dizilen çok sayıda polipeptid zincirleri arasında da oluşabilir. Bu tabaka birçok proteinin merkez kısmını oluşturur ve örümcek ağının ipek proteini de dahil, bazı fibröz proteinlerde baskın olarak bulunur. Çok sayıda hidrojen bağının birlikte etkisi, her örümcek ağı iliğini aynı ağırlıktaki çelikten yapılmış bir iplikten bile daha güçlü yapar.
/old/content_media/383ec1ea59e4ba0c7b90e78ee2f643af.jpg)
Üçüncül Yapı
Üst üste çakışmış ikinci yapı motifleri, bir proteinin üçüncül yapısıdır. İkincil yapı, omurga bileşenleri arasındaki etkileşimleri içerirken, üçüncül yapı çeşitli amino asit yan zincirleri (R grupları) arasındaki etkileşimlerle ortaya çıkar ve proteinin genel yapısını yansıtır.
Üçüncül yapıya katılan etkileşimlerden biri hidrofobik etkileşim olarak bilinir. Bir polipeptid, işlevsel biçimini almak üzere katlanırken, hidrofobik (polar olmayan) yan zincire sahip amino asitler genellikle suda uzaklaşarak, proteinin merkezinde kümelenme eğilimindedirler. Dolayısıyla hidrofobik etkileşim, polar olmayan bileşiklerin su moleküllerinden kaçma anlamına gelir.
Polar olmayan amino asit yan zincirleri birbirine yaklaştığında, van der Waals etkileşimleri onları bir arada tutar. Bu arada, polar yan zincirler arasındaki hidrojen bağları ve pozitif ve negatif yüklü yan zincirler arasındaki iyonik bağlar üçüncül yapının kararlı olmasına yardım eder.
Disülfid köprüleri denilen kovalent bağlar proteinin biçimini daha da güçlendirir. Disülfid köprüleri yan zincirlerinde sülfidril grupları (-SH) taşıyan sistein monomerlerinin proteinin katlanmasıyla birbirlerine yaklaşması sonucunda kurulur. Bir sisteinin kükürdü ikinci sisteinin kükürdü ile bağlanır ve disülfid köprüsü proteinin farklı kısımlarının bir araya getirir.
/old/content_media/81a77746268b78ff6a26fb9934dd141e.jpg)
Küçük molekül ve iyonlar üçüncül yapı üzerinde etkili olurlar. Bunların protoplazmadaki konsantrasyonları birçok enzimin şeklini, dolayısıyla aktivitesini etkiler. Magnezyum (Mg+2) ve kalsiyum (Ca+2) negatif yüklü R grupları ile etkileşerek üçüncül yapıyı değiştirir. Magnezyum ve kalsiyum yüksek düzeyde olması durumunda negatif yüklü iki bölge birbirine yapışabilir, bu iki katyon mevcut olmadığında ise negatif yüklü bölgeler birbirinden uzaklaşırlar.
Üçüncül yapı, pH ve sıcaklıktan etkilenir. Asitler ve bazlar tarafından salınan protonlar ve hidroksil iyonları yüklü R grupları ile etkileşerek, proteindeki çeşitli bölgelerin birbirlerini çekme veya itme şeklini değiştirirler. Proteinler ısıtılırsa, atom ve moleküller daha hızlı bir şekilde titreşirler ve katlanma yerleri açılır. Yumurta pişirirken olduğu gibi, yeterince ısıtılan proteinler açılır ve denatüre olmuş diye tanımlanırlar. Enzimler söz konusu olduğunda, seyreltik asit veya bazlar ya da hafifçe ısıtma bile aktif bölgenin şeklinin değişerek yeterince bozulmasına neden olur ve enzim işlev göremez.
Dördüncül Yapı
Bazı proteinler işlevsel tek bir makromolekül halinde bir araya gelmiş iki ya da daha fazla polipeptid zincirinden oluşmuştur. Dördüncül yapı, bu polipeptid alt birimlerinin bir araya gelmesiyle oluşan protein yapısıdır. Bu yapıya örnek olarak kolajen verilebilir. Kolajen, bir fibröz protein olan ve birbirine sarılmış üç adet özdeş helikal polipeptid zinciri içerir. Bu yapı uzun liflere büyük bir güç kazandırır. Bu güç kolajen liflerinin deri, kemik, tendonlar, ligamentler ve diğer vücut kısımlarındaki bağ dokunun askıları gibi iş görmesi için uygundur. Ayrıca kolajen, insan vücudundaki proteinlerin %40’ını oluşturur.
Bir başka dördüncül yapıya sahip olan protein örneği ise hemoglobindir. Bu protein dört adet alt birimden oluşur. Bunların ikisi alfa, diğer ikisi beta zincirdir. Hem alfa hem de beta alt birimler temel olarak a-helikal ikincil yapıya sahiptir. Her alt birim oksijene bağlanan demir atomuna sahip olan ve hem olarak adlandırılan polipeptid yapıda olmayan bir bileşen içerir.
/old/content_media/8912a9e6bff8e994c8974a51b26876cb.jpg)
Protein Yapısını Belirleyen Nedir?
Şu ana kadar protein yapısını belirleyen faktörleri gördük. Belirli bir amino asit dizisine sahip bir polipeptid zinciri, ikincil ve üçüncül yapıdan sorumlu olan etkileşimlerle belirlenen ve devam ettirilen 3 boyutlu biçimini kendiliğinden kazanır. Bu olay, hücre içindeki kalabalık ortamda proteinin sentezi sırasında diğer proteinlerin yardımıyla doğal olarak gerçekleşir.
Yani proteini oluşturan amino asitlerin yapısı, sayısı ve dizilimleri, proteinlerin tam olarak ne şekle sahip olacağını ve dolayısıyla ne işler yapabileceğini belirler. Örneğin kaslarımızı oluşturan uzun ve ince proteinler, bu şekilleri sayesinde uzayıp kısalabilirler; öte yandan, kemiklerimizi oluşturan uzun kolajen proteinleri, kemiklerimizdeki minerallerin birikebileceği bir kalıp görevi görürler. Bu tür uzunlamasına proteinlere fibröz proteinler deriz.
Öte yandan küresel (globüler) proteinler, isimlerinden de anlayabileceğiniz gibi, daha küresel bir şekle sahiptir. Bu şekilleri sayesinde tepkimeye girmeye çok daha meyillidirler ve çoğu zaman hidrofiliktirler, yani suyu severler (ortamda su molekülleri varsa, ona doğru çekilirler). Örneğin kan hücrelerimizde bulunan hemoglobin proteini, bu yapıda bir proteindir.
Bununla birlikte, proteinin yapısı, çevresindeki kimyasal ve fiziksel koşullara da bağlıdır. Eğer pH, tuz derişimi, sıcaklık ya da diğer çevre koşulları değişirse, zayıf kimyasal bağlar ve protein içindeki etkileşimler bozulabilir ve protein doğal biçimini kaybederek denatürasyon denilen bir değişikliğe uğrar. Denatüre protein, biçimini kaybetmiş olduğundan dolayı, biyolojik olarak aktif değildir.
Proteinlerin çoğu sulu ortamdan eter ya da kloroform gibi polar olmayan bir çözücü içine aktarıldığında, polipeptid zinciri, hidrofobik kısımları çözücünün bulunduğu dış tarafa doğru yönelecek şekilde yeniden katlanır ve denatüre olur. Denatürasyona neden olan diğer ajanlar arasında proteinin biçimini koruyan hidrojen bağlarını, iyonik bağları ve disülfit köprülerini kıran kimyasallar bulunur. Yapıyı kararlı kılan zayıf etkileşimleri kırarak, polipeptid zincirini bozan aşırı sıcaklık da denatürasyona yol açar. Pişirme sırasında yumurta akı opaklaşır, bunun nedeni, denatüre olan proteinlerin çözünmez hale gelerek katılaşmasıdır. Bu durum aşırı yüksek ateşin, neden öldürücü olabildiğini de açıklar. Yüksek vücut sıcaklıklarından kandaki proteinler denatüre olabilirler.
Test tüpü içerisinde çözeltide bulunan bir protein ısı ya da kimyasallarla denatüre edildikten sonra, denatüre edici ajanın ortamdan uzaklaştırılmasıyla, sıklıkla işlevsel biçimine tekrar geri dönebilir. Bu olgudan şu sonucu çıkarabiliriz: Özgül biçimin kurulması için gerekli bilgi, proteinin birincil yapısında mevcuttur. Birincil yapıyı amino asit dizilerinin oluşturduğunu biliyoruz. Amino asit dizisi proteinin yapısını belirler: alfa heliks nerede oluşacak, beta-pilili tabakalar nerede ortaya çıkacak, disülfit köprüleri nerede yer alacak, iyonik bağlar nerede kurulacak vs. gibi.
/old/content_media/34c55d76f278795a08eb7f3098ec6a18.jpg)
Protein Sentezi (Translasyon), İşlenmesi ve Düzenlenmesi
Proteinlerin sentezi mRNA kalıpları tarafından yönlendirir. Proteinler, genomik DNA'da kodlanan bilgilerle yönlendirilen çok sayıda işlemi gerçekleştirmede aktif rol oynarlar. Bu nedenle protein sentezi gen ekspresyonun son aşamasıdır (diğer aşamalar "replikasyon" ve "transkripsiyon" olarak bilinir).
mRNA'nın translasyonu, fonksiyonel protein oluşumunun ilk aşamasıdır. Polipeptid zincirleri aktif formlarına çevrilmeden önce çeşitli işlenme aşamalarından geçip katlanarak uygun üç boyutlu konformasyonunu almak zorundadır. Bu işlenme aşamaları, özellikle ökaryotlarda, farklı proteinlerin ayrılıp hücre içindeki uygun hedeflere varması ile yakından ilişkilidir.
Gen ekspresyonu, transkripsiyonun yanı sıra (DNA'daki bilginin RNA'ya aktarılması), translasyon aşamasında da kontrol edilmektedir ve bu kontrol hem ökaryot hem de prokaryot hücrelerde düzenlenme de önemli bir unsurdur. Bunun da ötesinde hücrede protein aktivitelerini kontrol eden mekanizmalar büyük önem taşımaktadır. Proteinlerin çoğu sentezlendikten sonra hücre dışından gelen sinyallere cevap olarak kovalent modifikasyonla veya diğer moleküllere bağlanarak düzenlenebilirler. Ek olarak hücre içinde proteinlerin düzeyi, protein yıkımının hızlarının değişmesi ile de kontrol edilebilmektedir. Hücre içi protein miktar ve aktivitelerinin bu yönlü kontrolü sonuçta hücre davranışını tüm yönleri ile düzenler.
/old/content_media/0e972110d87375d588690fa34877ae6f.jpg)
mRNA'nın Translasyonu
Proteinler, evrimsel süreç boyunca iyi korunmuş mRNA kalıplarından sentezlenirler. Tüm mRNA'lar 5’ den 3’ yönüne doğru okunurlar ve polipeptid zincirleri de amino ucundan karboksil ucuna doğru sentezlenirler. Her amino asit mRNA'da üç baz (kodon) tarafından tanımlanan, hemen hemen evrensel olan bir genetik koda göre belirlenir. Proteinin sentezinin temel mekanizmaları da tüm hücrelerde aynıdır: Translasyon, tRNA'nın mRNA ve proteine katılan amino asitler arasında adaptör rol oynaması ile ribozomlarda gerçekleşir. Böylece protein sentezi, translasyon için gerekli olan proteinlerin etkileşimi kadar üç tip RNA molekülü (mRNA kalıpları, tRNA ve rRNA) arasındaki etkileşimi de kapsar.
Taşıyıcı RNA
Translasyon sırasında 20 amino asidin her birinin mRNA kalıbı üzerindeki bunlara karşılık gelen kodonlara göre dizilmeleri gerekir. Tüm hücreler bu süreç için adaptör rolü oynayan çeşitli tRNA'ları bulundururlar. Buna göre, protein sentezindeki genel fonksiyonlara uygun olarak farklı tRNA’lar benzer yapıya sahiptir. Bununla birlikte, doğru amino asidin bağlanmasını ve mRNA’daki uygun kodonlarla dizilmesini sağlayacak kendine özgü tanımlayıcı dizileri de içerirler.
Bir genetik mesajın özel bir amino asit dizisi şeklinde translasyonunda anahtar olan taşıyıcı RNA (tRNA) molekülleri, birbirlerine tamamen benzemezler. tRNA moleküllerinin her bir tipi, belirli bir mRNA kodonunu, belirli bir amino aside tercüme ederler. Bir tRNA molekülü ribozoma ulaştığı zaman, bir ucunda özgül bir amino asit taşımaktadır.
tRNA'nın diğer ucundaki nükleotid üçlüsü antikodon olarak adlandırılır ve bu üçlü mRNA üzerindeki komplementer kodonla baz eşleşmesi yapar. Örneğin, mRNA kodonunun GGC olduğunu düşünelim, bu durumda kodon, glisin amino asiti olarak tercüme edilecektir. CCG antikodonuna sahip tRNA, bir taraftan hidrojen bağları ile kodona bağlanırken diğer ucunda ise glisin amino asidini taşıyacaktır. Bir mRNA molekülü ribozom üzerinde hareket ettirilirken, translasyon esnasında her ne zaman GGC kodonu ile karşılaşırsa, polipeptit zincirine glisin amino asiti eklenecektir. Bildirilen sıradaki amino asitlerin tRNA tarafından taşınması ve ribozomların, bu amino asitleri zincire eklenmesiyle genetik mesaj kodon kodon tercüme edilir. tRNA molekülü, bir anlamda tercümandır, nükleik asit kelimesi okuyabilir (mRNA kodonu) ve onu protein kelimesi (amino asit) olarak yorumlar.
/old/content_media/77e0bf72bde8a4f70c132ab2b57605f8.jpg)
mRNA gibi diğer hücresel RNA tipleri, taşıyıcı RNA molekülleri de kalıp DNA'lardan transkribe edilir. Bir ökaryotik hücrede, mRNA'ya benzer şekilde, tRNA da çekirdekte yapılır ve çekirdekten translasyonun yapıldığı sitoplazmaya nakledilmek zorundadır. Bakteriler ve ökaryotik hücrelerdeki her tRNA molekülü, sitozolde bulunan kendisine özgün amino asiti toplayıp, bu amino asitleri ribozomlardaki polipeptid zincirlerine taşıma ve biriktirmede tekrar tekrar kullanılır ve daha sonra, ribozomdan ayrılarak başka bir amino asidi toplamaya hazır vaziyettedir.
Bir tRNA molekülü sadece yaklaşık 80 nükleotid uzunluğunda tek bir RNA zincirinden oluşmuştur; mRNA ise yüzlerce nükleotid uzunluğundadır. Diğerleriyle hidrojen bağı kurabilen nükleotit bazlarının komplementer karşılıklarının varlığından dolayı, bu tek zincir kendi üstüne katlanabilir ve üç boyutlu yapıya sahip karakteristik yonca yaprağı şekli oluşturur.
X ışını kristalografisi çalışmaları, tüm tRNA’ların, daha sonra translasyon sürecinde ribozomlara uygun yerleşim için gerekli olan L şeklinde bir katlanma yaptığını göstermiştir. L'nin bir ucunda, özgül mRNA kodonuna bağlanan özelleşmiş baz üçlüsü olan antikodon bulunduran halkasal bir çıkıntı vardır. L-şeklindeki tRNA molekülünün diğer ucundan, 3’ ucu çıkıntı yapar; bu kısım, bir amino asidin bağlandığı yerdir. Böylece tRNA molekülünün yapısı, işlevine uyar.
Bir genetik mesajın doğrulukla tercüme edilmesi, moleküler tanımanın iki aşamasını gerektirir. İlk olarak, belirli bir amino asidi belirleyen mRNA koduna bağlanan bir tRNA, başka birisini değil sadece o amino asidi ribozoma taşımalıdır. tRNA ve amino asidin doğru eşleşmesi, aminoasil-tRNA sentetaz adı verilen bir enzim ailesi tarafından gerçekleştirilir.
Aminoasil-tRNA sentetazın her bir tipinin aktif merkezi, sadece özgül amino asit ve tRNA kombinasyonuna uyar. Yani bunlar, tRNA’nın antikodon ucu ve amino asit tutunma ucunun her ikisi de, özgül uyumu garantileyen aletlerdir. Her amino asit için bir enzim olmak üzere, hücrede 20 farklı sentetaz vardır; her sentetaz, kendi belirli amino asidini kodlayan tüm farklı tRNA’lara bağlanabilirler. Sentetaz, ATP’nin hidroliziyle yürütülen bu süreçte, kendi tRNA’sına amino asidin kovalent olarak bağlanmasını katalizler. Sonuçta oluşan ve aynı zamanda yüklü tRNA adı da verilen aminoaçil tRNA, enzimden salınır ve ondan sonra, ribozom üzerindeki uzayan polipeptit zincirine kendi amino asidini vermeye uygundur.
/old/content_media/853bd4a96d82c6cf1ba2aa13878ad4e0.jpg)
Moleküler tanımanın ikinci örneği, tRNA antikodonunun uygun mRNA kodonu ile eşlemesidir. Eğer, bir amino asidi tanımlayan her bir mRNA kodonuna karşılık, bir tRNA olsaydı 61 adet tRNA molekülü tipi olacaktı. Gerçekte, sadece yaklaşık 45 çeşit tRNA vardır. Bu durumda bazı tRNA’lar, birden fazla sayıda kodonu tanıyıp bağlanmak zorundadır. Bir kodonun üçüncü bazı ve tRNA antikononundaki bunun karşılığı olan baz arasındaki baz-eşleşmesi kuralları, diğer kodon pozisyonlarındakilerle oranla daha esnek olduğundan böyle çok yönlülüğün sağlanması olasıdır.
Örneğin, bir tRNA antikodonunun 5’ ucundaki U nükleotid bazı, bir mRNA kodonunun üçüncü pozisyonundaki A ya da G’den herhangi birisiyle eş oluşturabilir. Bu kodon pozisyonundaki esnek baz-eşleşmesi Wobble olarak adlandırılır. Wobble, herhangi bir amino asit için eş kodonlarındaki farklılığın, niçin en fazla, onların üçüncü nükleotid bazında olduğunu, fakat diğer bazlarda olmadığını açıklar. Örneğin, antikodonu 3’-UCU-5’ olan bir tRNA, her ikisi de arginini kodlayan 5’-AGA-3’ ya da 5’-AGG-3’ şeklindeki mRNA kodonları ile baz eşleşmesi yapabilir. Kısaca Wobble Hipotezi, mRNA kodonu ve tRNA’daki antikodonun ilk iki bazı özgün eşleşip değişmez iken, 3. kodonun esnek davranabilir olmasıdır.
Ribozomlar
Ribozomlar, hem ökaryot hem de prokaryot hücrelerde protein sentez bölgeleridir. İlk kez hücre özütlerinin ultrasantrifügasyonunda partiküller olarak fark edilen ribozomlar; bakteri ribozomları 70S ve daha büyük olan ökaryot hücrelerdeki 80S olmak üzere, genellikle çökme hızlarına göre adlandırılırlar. Prokaryot ve ökaryot ribozomların her ikisi de, her biri karakteristik protein ve rRNA içeren iki ayrı alt birimden oluşmaktadır. Aslında, hücrelerin çok sayıda ribozom içermesi protein sentezinin hücre metabolizmasındaki temel öneminin bir göstergesidir. Örneğin; E. coli kuru hücre ağırlığının yaklaşık %25’ine karşılık gelen 20 bin dolayında ve hızlı büyüyen memeli hücreleri ise, yaklaşık 10 milyon ribozom içermektedir.
Bazı ayrıntılarda farklar olmakla beraber, ökaryot ve prokaryot ribozomlarının genel yapısı benzerdir. E. coli ribozomlarının küçük alt birimi (30S), 16S rRNA ve 21 proteinden, büyük alt birimi (50S) 23S ve 5S rRNA ve 34 proteinden oluşur. Her ribozom, 50S alt birimde dört kopya halinde bulunan bir protein hariç, rRNA ve proteinlerden tek kopya bulundurur. Ökaryot ribozomlarının alt birimleri prokaryotlardaki karşılıklarına göre daha büyüktür ve daha fazla protein içerir. Ökaryot ribozomların küçük alt birimi (40S) 18S rRNA ve yaklaşık 33 proteinden, büyük alt birim (60S) 28S, 5,8S ve 5S rRNA ile yaklaşık 46 proteinden oluşmaktadır.
/old/content_media/f5f8cc618e9f37645fc14d3786d1454b.jpg)
Bakteri ve ökaryot ribozomların moleküler kompozisyon bakımından da birbirinden farklılık gösterir. Bu farklılık tıbbi açıdan önemlidir. Belirli antibiyotikler, ökaryotik ribozomların protein yapma yeteneğini inhibe etmeksizin bakteri ribozomlarını etkisiz hale getirmektedir. Tetrasiklin ve streptomisinin de aralarında bulunduğu ilaçlar, bakteriyel enfeksiyonlarla savaşta kullanılırlar.
Ribozomların önemli bir özelliği, in vitro koşullarda RNA ve protein bileşenlerinin kendiliğinden bir araya gelmesiyle yeniden oluşabilmeleridir. Yani saflaştırılmış ribozomal proteinler ve rRNA'lar uygun koşullar altında bir araya getirilirse fonksiyonel ribozom oluşmaktadır. tRNA'lar gibi rRNA'lar da komplementer baz eşleşmesi ile kendilerine özgü sekonder yapı oluştururlar. Daha sonra rRNA'lar ribozomal proteinlerle bağlanarak daha ileri üç boyutlu yapılara katlanırlar.
Başlangıçta, rRNA’ların sadece ribozomal proteinlerin bir araya gelmesi için iskelet oluşturarak yapısal rol oynadığı düşünüldü. Bununla birlikte diğer RNA moleküllerinin katalitik aktivitelerinin (örneğin: RNaz P ve kendi kendini uzaklaştıran intronlar) keşfedilmesi ile rRNA’nın da katalitik rol oynayabileceği gösterilmiştir.
Ribozomun yapısı, mRNA'nın amino asit taşıyan tRNA'larla bir araya getirilmesi işlevini yansıtmaktadır. Her bir ribozom, mRNA'nın bağlandığı bölgeye ilave olarak tRNA için üç adet bağlanma bölgesine sahiptir. A bölgesi (aminoasil-tRNA bağlanma bölgesi) zincire eklenecek bir sonraki amino asiti taşıyan tRNA’yı bağlarken, P bölgesi (peptidil-tRNA bağlanma bölgesi) uzamakta olan peptid zincirini taşıyan tRNA’yı bağlar.
Taşıdığı amino asiti bırakan tRNA'lar, ribozomun E bölgesinden (çıkış bölgesi) terk eder. Ribozom, tRNA ve mRNA’yı birbirine yakın konumda tutar ve yeni amino asit uzamakta olan peptidin karboksil ucuna eklemek üzere yerleştirir. Daha sonra da peptid bağının oluşumunu katalizler. Polipeptid daha uzun hale gelince, ribozomun büyük alt birimdeki çıkış tüneline geçer. Polipeptid tamamlandığı zaman, çıkış tünelinden geçerek ortama salınır.
Ribozomun yapı ve fonksiyonun her ikisinden de öncelikle sorumlu olanın protein değil rRNA olduğuna ilişkin hipotezi, çok sayıda kanıtla güçlü bir şekilde desteklenmektedir. Büyük ölçüde dış tarafta bulunan proteinler, rRNA molekülleri translasyon sırasında katalizlenmeyi gerçekleştirirken, bu moleküllerde meydana gelen biçim değişikliklerini destekler. Ribozomal RNA, iki alt birim ve A ve P bölgeleri arasındaki ara yüzün temel bileşenidir; ve rRNA, peptid bağı oluşumunun katalizörüdür.
Mesajcı RNA'nın Organizasyonu ve Translasyonun Başlaması
Her ne kadar prokaryot ve ökaryot hücrelerde protein sentez mekanizmaları benzese de, özellikle mRNA kalıbı üzerinde polipeptid zinciri sentezinin başladığı pozisyonu tanımlayan sinyaller gibi bazı farklar da mevcuttur.
Çeviriü 5’ ucunda basit bir şekilde değil, özel başlama bölgelerinden başlar. Bu nedenle hem prokaryot hemde ökaryot hücrelerde 5’ terminal kısmı, kodlanmayan diziler içerir ve proteine çevrilmeyen 5’ bölgesi (UTR) olarak adlandırılır. Ökaryot mRNA’lar genellikle tek bir polipeptid zinciri kodlar ancak prokaryot mRNA’ları ayrı ayrı başlama bölgelerinden bağımsız olarak sentezlenen birçok polipeptid kodlar. Tek polipeptid kodlayan mRNA’lar monosistronik, birden fazla polipeptid kodlayan mesajcı mRNA’lar ise polisistronik olarak adlandırılır. Hem prokaryot hem de ökaryot mRNA’lar, proteine çevrilmeyen 3’ bölgesi ile sonlanırlar.
Hem prokaryot hem de ökaryot hücrelerde çeviri genellikle, daima AUG tarafından kodlanan metionin amino asidi ile başlar. GUG gibi alternatif başlama kodonları bazen bakteriler tarafından kullanılır, ancak bu kodonlar polipeptid zincirinin başında oldukları zaman normalde kodladıkları amino asit yerine (GUG normalde valin kodlar) metiyonin kalıtımını yönlendirirler. Ökaryotlarda modifiye olmamış metiyonin protein sentezi başlatırken (ribozomları bakterinınkine benzeyen mitokondri ve kloroplastlar hariç) bakterilerin çoğunda protein sentezi modifiye metionin (N-formil metiyonin) ile başlar.
Monosistronik ve polisistronik mRNA’ların farklı işlevleriyle uyumlu olarak, prokaryot ve ökaryot hücrelerde başlama kodonlarını tanımlayan sinyaller de farklıdır. Bakterilerde başlama kodonlarından önce, 16S rRNA’nın 3’ ucuna yakın komplementer dizi ile baz eşleşmesi oluşturarak mRNA’yı translasyon için ribozomlar üzerine yerleştiren özgün bir dizi Shine-Dalgarno dizileri yer alır. Bu baz eşleşmesi etkileşimi bakteri kromozomlarının yalnızca mRNA’nın 5’ ucunda değil, aynı zamanda polisistronik mesajların internal başlama bölgelerinde de translasyonu başlatmasına olanak verir. Bunun aksine ribozomlar ökaryot mRNA’yı 5’ ucundaki 7-metilguanozin "kep" bölgesine bağlanarak tanır. Daha sonra ribozomlar 5’kep bölgesinden aşağıya doğru AUG kodonunu buluncaya kadar tararlar. AUG etrafındaki diziler başlama kodunun etkinliğini değiştirebilir, bazı durumlarda mRNA’daki ilk AUG kodonu atlanır ve çeviri daha ileride ki AUG’den başlar.
mRNA üzerinde, içeride bir pozisyonda, ribozomun bağlanarak translasyonu başlatacağı internal ribozom giriş bölgelerinin çeşitli viral ve bazı hücresel RNA’lar bulunmaktadır. Bu alternatif başlama mekanizması hücrelerin stres şartları altında iken 5’ kep normal başlama fonksiyonlarının inhibe edilmesi ile, bazı mRNA’ların seçici olarak translasyonuna olanak sağlamak olduğu düşünülmektedir.
Translasyon Süreci
Proteine çevrim (translasyon) genellikle; başlama, uzama ve sonlanma olmak üzere üç aşamada gerçekleşir. Hem prokaryot hem de ökaryotlarda başlangıç evresinin ilk aşaması mRNA’nın ve özgül başlatıcı metionil tRNA’nın küçük ribozomal alt birime bağlanmasıdır. Daha sonra polipeptid zincirinin uzamasının devam ettirecek fonksiyonel ribozomu oluşturacak büyük ribozomal alt birim bu komplekse katılır. Translasyon sürecinin çeşitli aşamalarında çok sayıda özgül ribozomal olmayan proteinlere de gereksinim duyulur. Bunlara genel olarak translasyon faktörleri adı verilir.
Bakteride translasyon başlangıç evresi, iki başlangıç faktörünün IF-1 ve IF-3, 30S ribozomal alt birime bağlanması ile başlar. Üçüncü başlangıç faktörü (GTP’ye bağlı olan başlatma faktörü), mRNA ve N-formil metiyonin tRNA ile birlikte komplekse katılır. IF-2, özellikle öncül tRNA ile etkileşim halindedir. tRNA, mRNA’nın başlangıç kodonuna bağlanır, böylece IF-1 ve IF-3 serbest kalır. Daha sonra 50S ribozomal alt biriminin komplekse birleşmesi, GTP’ye bağlı IF2 hidrolizini tetkikler ve IF2 başlangıç kompleksi oluşumu ile kompleksten ayrılarak serbest kalır. Sonuç olarak bir 70S (mRNA ve başlatıcı tRNA) hazırdır. Bu kompleks translasyonun uzama evresinde peptid bağı oluşumunu başlatır.
Ökaryotlarda başlangıç aşaması çok daha karmaşıktır ve ökaryotlar eIF’ler (ökaryot başlangıç faktörleri) olarak belirtilen en az 12 proteine (her biri çoklu polipeptid zincirinden oluşur) gereksinim duyarlar. eIF1, eIF1A ve eIF-3 faktörleri 40S ribozomal alt birime bağlanır ve eIF2 (GTP ile kompleks halinde) başlatıcı metionil tRNA ile ilişki kurar. 40S alt biriminin öncül tRNA ile birleşmesi ile başlama öncesi kompleks oluşur. Mesajcı RNA eIF4 grubu tarafından tanınır ve ribozoma götürülür. mRNA’nın 5’kep kısmı ise, eIF4E tarafından tanınır ve ribozoma götürülür.
Diğer bir faktör eIF4G, hem mRNA’nın 3’ ucundaki poli A kuyruğuna bağlı olan bir proteine (poli A bağlanan protein veya PABP) hem de eIF4E’ye bağlanır. Böylece ökaryot başlama faktörleri mRNA’nın 3’ ve 5’ olmak üzere her iki ucunu da tanır. Başlama faktörleri eIF4E ve eIF4G ile eIF4A ve eIF4B etkileşir ve daha sonra eIF4G’nin eIF3 ile etkileşimi ile mRNA’yı 40S ribozomal alt birime getirir. 40S ribozomal alt birim üzerine bağlı olan metionil tRNA eIF’ler ile birlikte AUG başlama kodonunu belirlemek üzerek mRNA’yı tarar. AUG kodonuna ulaşıldığı zaman, eIF5 ve eIF2’ye bağlı olan GTP’nin hidrolizini tetikler. Bunun üzerine başlama faktörleri ayrılır ve 60S alt birim 40S alt birime bağlanarak ökaryot hücrelerin 80S kompleksini oluştururlar.
Bazı viral ve ökaryotik mRNA’lar iç kısımlarında translasyonun 5’ kep bölgesinden bağımsız olarak başlayabileceği ribozoma giriş bölgesi (IRES) içerirler. Viral mRNA’larda bu ya IRES dizilerinin doğrudan eIF4G’ye bağlanmasıyla ya da eIF4A veya 40S ribozomal alt birimle kompleks oluşturarak bağlanması ile düzenlenir. IRES’in hücresel mRNA’lardaki etki mekanizması tam olarak anlaşılmamıştır, ancak eIF4G-eIF4A kompleksine bağlanması ile ilişkili olduğu düşünülmektedir.
Başlama kompleksi oluştuktan sonra, translasyon polipeptid zincirinin uzaması ile devam eder. Uzamanın mekanizması prokaryot ve ökaryot hücreler de birbirine benzerdir. Daha önce ribozomun P-A-E bölgelerinden bahsetmiştik. Başlatıcı metionil tRNA ribozomun P bölgesine bağlanır. Uzamanın aşamasındaki ilk adım, bir sonraki tRNA’nın mRNA’daki ikinci kodonla eşleşerek, A bölgesine bağlanmasıdır. Aminoaçil tRNA, GTP ile bağlanmış bir uzama faktörü (prokaryotlarda EF-Tu, ökaryotlarda Eef1α) tarafından ribozoma getirilir.
Uzamakta olan polipeptit zincirine katılmak üzere doğru aminoaçil tRNA’nın seçilmesi, protein sentezinin doğruluğunu belirleyen kritik bir aşamadır. Her ne kadar bu seçim, mRNA’daki kodon ve tRNA’Daki antikodon arasındaki baz eşleşmesine dayansa da, baz eşleşmesi tek başına protein sentezinin 10-3’den daha az olan hata oranı ile doğruluğu sağlamada yeterli değildir. Bu doğruluk, küçük ribozomal alt birimdeki, doğru kodon-antikodon baz eşleşmesini tanıyan ve yanlış eşleşmeleri ayıran ‘deşifre merkezi’ tarafından sağlanır.
Doğru aminoaçil tRNA’nın A bölgesine yerleşmesi Eef1α’ya bağlı olan GTP’nin hidrolizini ve GDP- bağlı uzama faktörünün ayrılmasına uyaran bir konformasyonel değişikliği tetikler. Ribozomlarla ilgili son yapısal çalışmaların dikkate değer bir sonucuda, peptidil transferaz aktivitesi gibi, deşifre merkezinde doğru kodon-antikodon eşleşmesinin algılanmasının proteinlerle değil, esas olarak ribozomal RNA’nın aktivitesine dayanıyor olmasıdır.
Eef1α ribozomu terk ettiği zaman, P bölgesindeki başlatıcı metionil tRNA ve A bölgesindeki ikinci aminoaçil tRNA arasında peptid bağı oluşabilmektedir. Bu reaksiyon ribozomal RNA’nın kritik rolüyle, büyük ribozomal alt birim tarafından katalizlenir. Sonuç, metiyoninin ribozomun A bölgesindeki aminoaçil tRNA’ya transferi ile bu pozisyonda peptidil tRNA oluşması ve P bölgesindeki başlatıcı tRNA’nın yüksüz kalmasıdır.
Uzamadaki, ikinci adım, diğer bir uzama faktörünü gerektiren (prokaryotlarda EF-G, ökaryotlarda eEF2) yeni bir GTP hidrolizi ile birlikte ilerleyen translokasyondur. Translokasyon sırasında ribozom, bir sonraki kodon boş A bölgesine gelecek şekilde, mRNA üzerinde üç nükleotid kayar. Bu aşama peptidil tRNA’yı A bölgesinden P bölgesine, yüksüz tRNA’yı P bölgesinden E bölgesine aktarır. Böylece ribozom, A bölgesi boş ve P bölgesinden peptidil tRNA bağlı olarak kalır. A bölgesi yeni bir aminoaçil tRNA’nın bağlanması E bölgesindeki yüksüz tRNA’nın ayrılmasını uyarır, böylece ribozom, büyüyen polipeptid zincirine bir sonraki amino asitin katılımı için hazır hale gelir.
Uzama devam ederken ribozomdan ayrılan GDP Eef1α (veya EF-Tu) GTP formuna geri dönmelidir. Bu dönüşüm için Eef1α/GDP kompleksine bağlanarak, bağlı GDP’nin GTP ile değişimini uyaran üçüncü bir uzama faktörü eEF1β¥ (prokaryotlarda EF-Ts) gereklidir. Bu değişim Eef1α/GTP’nin yenilenmesiyle sonuçlanır ve yeni bir uzama döngüsünü başlatmak üzere bir aminoaçil tRNA’yı ribozomun A bölgesine götürür. GTP bağlanması ve hidrolizi ile Eef1α’nın düzenlenmesi protein aktivitelerinin genel anlamdaki düzenlenmesidir.
Polipeptid zincirinin uzaması, dur kodonu (UAA, UAG veya UGA) ribozomun A bölgesine gelinceye kadar devam eder. Hücrelerde bu sonlanma sinyallerine karşı gelen antikodona sahip tRNA’lar bulunmaz, bunun yerine sinyalleri tanıyan sonlandırma faktörleri bulunur ve protein sentezini sonlandırılır. Prokaryot hücrelerde bitiş kodonlarını tanıyan iki sonlandırma faktörü bulunur; RF-1 UAA veya UAG’yı tanır, RF-2 ise UAA veya UGA’yı tanır.
Ökaryot hücrelerde tek sonlandırma faktörü eRF1 her üç sonlandırma kodonunu da tanır. Ökaryot ve prokaryot hücrelerin her ikisinde de özgül bitiş kodonlarını tanımayan, ancak RF1 (veya eRF1) ve RF2 ile birlikte iş gören sonlandırma faktörleri bulunur (sırasıyla RF3 ve eRF3). Sonlandırma faktörü A bölgesindeki bitiş kodonuna bağlanır ve tamamlanmış polipeptidin ribozomdan salınımına neden olan P bölgesindeki polipetid ve tRNA arasındaki bağın hidrolizini tetikler. Daha sonra tRNA sertbest kalır ve ribozomal alt birimlerle mRNA kalıbı birbirinden ayrılırlar.
Prokaryot ve ökaryot hücrelerinin her ikisinde de tek bir mRNA molekülü eş zamanlı olarak, çok sayıda ribozom tarafından okunabilir. Bir ribozom başlama bölgesinden uzaklaşır uzaklaşmaz, bir başkası mRNA’ya bağlanır ve yeni bir polipeptid sentezi başlar. Böylece mRNA genellikle aralarında 100 ile 200 nükleotid aralık bulunan ribozom serileri tarafından proteine çevirilirler. mRNA’ya bağlı ribozom grupları, poliribozom veya polizom olarak adlandırılırlar. Grup içinde her ribozom, farklı bir polipeptid zincirini sentezinde bağımsız olarak görev yapar.
Translasyonun Düzenlenmesi
Gen ekspresyonun düzenlenmesi de transkripsiyon ( RNA sentezi ) ilk aşama olmakla beraber, gen ifadesi değiştirilmesinde mRNA’nın translasyonunda anahtar rol oynar. Bazı özel mRNA’ların translasyonu hem translasyonu baskılayan proteinler ile, hem de kodlamayan mikro RNA’lar tarafından düzenlenebilmektedir ki bunlar ökaryot hücrelerin gen ifadesinin düzenlenmesinde başlıca düzenleyicilerdir. İlave olarak hücrelerin global çevrimsel aktiviteleri hücresel streslere, besin miktarına ve büyüme faktörü uyarılarına cevap olarak da değişebilir.
Baskılayıcı proteinlerin (translasyonu engeller) özgül mRNA dizilerine bağlanması translasyonu düzenleyen mekanizmalardan biridir. Bu mekanizmanın iyi bilinen bir örneği hücrede demir depo eden protein ferritin sentezinin düzenlenmesidir. Ferritin mRNA’sının çevrilmesi demir miktarı tarafından düzenlenir, demir fazla ise ferritin de daha fazla sentezlenir. Bu düzenleme, demir eksikliğinde ferritin mRNA’sının 5’ proteine çevrilmeyen bölgesindeki dizilere (demir yanıt elemanı (IRE)) bağlanarak translasyonu engelleyen demir düzenleyici proteinler tarafından sağlanır. Demir varlığında demir düzenleyici proteinler IRE dizilerine bağlanamaz ve ferritin translasyonu devam eder. IRE 5’kep bölgesindeki 40 nükleotid içerisinde yer alır ve öyle görülür ki demir düzenleyici proteinler mRNA’nın 40S ribozomal alt birime bağlanmasını engelleyerek translasyonu baskılar.
/old/content_media/d64ffc0c8b60d51be99781bd6b2c282f.png)
Translasyon aynı zamanda bazı mRNA’ların 3’ proteine çevrilmeyen bölgelerindeki özgül dizilere bağlanan proteinler tarafından da düzenlenebilmektedir. Bir çok durumda bu translasyonel baskılayıcılar başlatma faktörü eIF4E’ye bağlanarak eIF4E ve eIF4G’nin etkileşimini bloklar ve translasyonun başlamasını engelleyerek iş görür.
/old/content_media/350482caa7c9004ef415f0e654ccffbe.jpg)
mRNA’nın 3’ proteine çevrilmeyen bölgesine bağlanan proteinler aynı zamanda mRNA’ların hücrede belli bölgelere yerleşip, proteinlerin özgül hücre içi bölgelerde üretilmesine imkan verir. Yumurta hücresi, embriyolar, sinir hücreleri ve hareketli fibroblastlar dahil olmak üzere bir çok hücre tipinde mRNA’nın yerleşimi translasyonun düzenlenmesinin önemli bir parçasıdır. Örneğin, mRNA’nın yumurta ve embriyoda özgül bölgeye yerleşmesi, gelişen embriyoda proteinlerin doğru yerlerde sentezlenmesine izin vererek gelişimde büyük rol oynar.
Translasyonun düzenlenmesi özellikle erken gelişim sırasında önemlidir. Oositlerde (döllenmemiş yumurta) çeşitli mRNA’lar proteine çevrilmeyecek şekilde depolanır, bu mRNA’ların translasyonu fertilizasyonda veya gelişimin ileri evrelerinde aktive olur. Bu translasyonel düzenlemenin bir mekanizması da oosit mRNA’ların kontrollü poliadenilasyonudur. Oositlerde çok sayıda proteine çevrilmeyen kısa poli A kuyruğu bulunan mRNA’lar (30-50 nükleotid) depolanır. Bu depolanmış mRNA’lar daha sonra poli A kuyrukları birkaç yüz nükleotide uzatılarak, gelişimin uygun evrelerinde tekrar translasyon için iş başına gelirler.
/old/content_media/56c50bc1283bf9f2c56d8b5b4c2c5166.jpg)
Kodlanmayan RNA’ların gen ifadesinin düzenlenmesinde rolleri büyüktür. RNA aracılığı ile RNA interferens (RNAi) gen ifadesinin durdurulması, hücreler tarafından translasyonun düzenlenmesinde kullanılan önemli bir araçtır. RNA interferensi düzenleyen başlıca iki tip kısa RNA’dan kısa engelleyici RNA (siRNA) ve mikroRNA (miRNA) her ikisi de 22 nükleotid uzunluğundadır. siRNA’lar daha uzun çift zincirli RNA’ların Dicer’ nükleazlar tarafından kesimi ile oluşurlar. Daha uzun çift zincirli siRNA öncülleri hücrelere deneysel olarak verilebilirler. Bunun aksine öncül miRNA’lar, RNA polimeraz II tarafından yaklaşık 70 nükleotid uzunluğunda primer transkript olarak transkribe olurlar ve daha sonra Drosha ve Dicer nükleazlar tarafından kesilerek 22 nükleotidlik çift iplikli RNA’ları oluştururlar.
miRNA ve siRNA, her ikisinin de bir ipliği RNA ile uyarılan susturucu komplekse (RNA-ınduced silencing complex-RISC) katılır ve siRNA veya miRNA RISC kompleksini komplementer mRNA’ya hedefler. siRNA’lar genellikle hedefleri ile kusursuz çift oluşturup hedef mRNA’nın RISC bileşeni tarafından yıkımını uyarırken, miRNA’ların büyük bir kısmı hedef mRNA’larının 3’ proteine çevrilmeyen bölgeleri ile yanlış eşleşmiş çift iplikler oluşturur. Bu durumda mRNA’yı miRNA/RISC kompleksi yıkmaz bunun yerine deadenilasyonu (belirli bir RNA sınıfı olan haberci RNA'ların (mRNA) sonunda bulunan bir dizi adenozini bağlı bulunduğu bölgeden çıkarır. Bu özel nükleotidin çıkarılması, mRNA'ların bozulmasına neden olur.) uyararak mRNA’yı yıkıma hedefler ve translasyonu baskılar.
miRNA’ların gen düzenlenmesindeki rolü çok büyüktür. Memeli genomundan kodlanan miRNA sayısının 1000 kadar olduğu tahmin edilmektedir. Yanı sıra her miRNA 100 farklı mRNA’yı hedefleyebilir ve protein kodlayan faktörlerinin yarısının miRNA ile düzenlendiği tespit edilmiştir. Biyolojik rolleri yeni keşfedilmekler birlikte, miRNA’lar çeşitli gelişimsel süreçler, hücre çoğalması ve sağ kalım süreçlerin düzenlenmesinde önemli bir rol oynamaktadır. miRNA’ların aynı zamanda hücre çoğalması ve sağ kalmasını da düzenlediği gösterilmiş ve miRNA’ların anormal ekspresyonunun kanser ve diğer hastalıkların gelişimine katkısı olduğu bulunmuştur. Bu nedenle, hem miRNA etki mekanizmasının, hem de biyolojik rollerinin tüm yönleriyle anlaşılması çok aktif bir araştırma alanlarıdır.
Ökaryotik hücrelere özgül mRNA’ların translasyonundan çok tüm translasyonel aktiviteleri etkileyen diğer bir translasyonel düzenleme mekanizması, eIF2 ve eIF4E başta olmak üzere başlatma faktörleri aktivitelerinin değişimini kapsar. Önceden bahsedildiği gibi eIF2 GTP ile kompleks oluşturarak başlatıcı metionin tRNA’ya bağlanır ve onu ribozoma getirir. Daha sonra eIF2’nin ayrılmasına GTP hidrolizi eşlik eder eIF2 inaktif GDP kompleksi olarak kalır.
Diğer bir döngünün başlamasına katılabilmek için eIF2/GTP kompleksi üzerine bağlı GDP’nin GTP’ye dönüşümünü yenilemesi gerekir. Bu dönüşüm diğer bir faktör olan eIF2B tarafından sağlanır. eIF2’nin düzenlenmesi çeşitli ökaryotik hücrelerde kritik kontrol noktasını oluşturur. Özellikle eIF2 ve eIF2B’nin her ikisi de düzenleyici protein kinazlar tarafından fosforlanabilir. Bu fosforilasyonlar bağlı GDP’nin GTP’ye dönüşümünü engelleyerek translasyonun başlamasını engeller. Örneğin memeli hücreleri büyüme faktörü açlığı veya stres ile karşılaşırlarsa protein kinazlar eIF2 ve eIF2B’yi fosforlayarak protein sentezinin ilerlemesini engeller.
Büyüme faktörlerinin rol oynadığı protein sentezi kontrolünde mRNA’nın 5’kep bölgesine bağlanan eIF4E aktivitesinin düzenlenmesini diğer bir kritik noktadır. Örneğin memeli hücrelerinde protein sentezini uyaran büyüme faktörleri eIF4E’ye bağlanan düzenleyici proteinleri (eIF4E’ye bağlanan proteinler veya 4E-BP) fosforile eden protein kinazları aktive ederler. Uygun büyüme faktörü yokluğunda, fosforlanmamış 4E-BP’ler eIF4E’ye bağlanırlar ve eIF4E ile eIF4G arasındaki etkileşimleri bozarak translasyonu inhibe ederler. Yeterli miktarda büyüme faktörlerinin bulunması halinde 4E-BP’lerin fosforilasyonu bunların eIF4E ile etkileşimini engeller ve bu da translasyonun başlama hızının artmasına neden olur.
Translasyonun tamamen baskılanması, aslında bazı mRNA’ların seçici olarak translasyonu uyardığı da dikkate değer bir konudur. Örneğin, iç kısmında ribozom giriş bölgesi bulunan mRNA’lar, eIF4E’nin baskılandığı ve bu nedenle kep bağımlı başlangıcının engellendiği durumlarda seçici olarak çevirilirler. Böyle bir grup mRNA’nın seçici olarak çevrilmesi hücrelerin açlık, büyüme faktörü yokluğu veya DNA hasarı gibi durumlarla başa çıkmasına yardımcı olur.
Protein Katlanması ve İşlenmesi
Protein translasyon ile hücrede genetik bilgi akışı tamamlanır. Böylece, DNA’daki nükleotid dizisi polipeptid zincirinde amino asit dizisine çevrilmiş olur. Ancak, polipeptidin sentezi fonksiyonel proteinin üretimine eşdeğer değildir. Kullanılır hale gelmesi için, polipeptidin üç boyutlu konformasyonuna katlanması ve birçok durumda da, fonksiyonel kompleksi oluşturmak üzere polipeptid zincirlerinin bir araya gelmeleri gerekir. Ek olarak birçok protein hücre içinde doğru yerleşim ve fonksiyonları için kritik olan kesim, karbonhidratların ve lipitlerin kovalent bağlanması da dahil olmak üzere daha ileri değişimlere gitmektedir.
Şaperon ve Protein Katlanması
Daha önce de bahsedildiği gibi proteinlerin üç boyutlu konformasyonları onları oluşturan amino asitlerin yan grupları arasındaki etkileşimin sonucudur. Protein katlanmasının klasik prensibi, bir proteinin doğru üç boyutlu yapıya ulaşması için gerekli tüm bilginin amino asitler tarafından sağlandığıdır. Bu yüzden protein katlanması ek hücresel faktörlerin gerekmediği, kendi kendine yapılanma süreci görülmekteydi. Bununla birlikte yakın zamandaki çalışmalar bunun hücre içindeki protein katlanması için yeterli bir tanım olmadığını göstermiştir. Proteinlerin hücre içindeki doğru katlanması başka proteinlerin aktiviteleri aracılığı ile sağlanmaktadır.
Diğer proteinlerin katlanmasını kolaylaştıran protein moleküller şaperonlar olarak adlandırılır. Şaperonların, polipeptidlerin doğru üç boyutlu yapıya katlanması için gerekli olan ek bilgiler taşımadığını ve proteinlerin katlanmış konformasyonlarının sadece onun amino asit dizisi tarafından tanımlandığını söylemekte fayda vardır. Şaperonlar protein katlanmasını daha çok kendiliğinden yapılanma sürecinde yardımcı olarak katalizlerler.
Şaperonların fonksiyonunun, en son doğru katlanmaya giden yoldaki ara ürünler olan katlanmamış veya kısmen katlanmış polipeptitlere bağlanarak onların kararlılıklarını sağlamak olduğu düşünülmektedir. Şaperonların yokluğunda, katlanmamış veya kısmen katlanmış polipeptid hücre içinde kararsız halde kalabilirler. Şaperonların bağlanması ve bu katlanmamış polipeptitleri stabilize eder, böylece hatalı katlanmayı veya kümelenmeyi engelleyerek polipeptidlerin doğru konformasyona katlanmasına olanak sağlar.
Şaperonların, ribozom üzerinde sentezlenmekte olan yeni polipeptit zincirine bağlanarak hatalı katlanmayı ya da sentez bitmeden polipeptidin amino ucunun kümelenmesini önler. Proteinler, 100 ile 300 amino asitlik bölümler halinde katlanırlar. Bu durum sentezlenmekte olan zincirin tüm bölgeleri tamamlanıncaya kadar, yeni zincirin hatalı katlanmadan veya diğer proteinler ile kümelenmeden koruması ve proteinin doğru konformasyona katlanabilmesi için gereklidir. Şaperon bağlanması, katlanmamış konformasyondaki amino terminalini polipeptidin geri kalan kısmı sentezlenip proteinin doğru katlanması tamamlanıncaya kadar stabilize eder.
Şaperonlar aynı zamanda katlanmamış polipeptid zincirlerinin organellere taşınması sırasında da örneğin proteinlerin sitozolden mitokondriye taşınmasında olduğu gibi kararlı halde tutarlar. Proteinler mitokondri zarlarından, sitozolde şaperonlar tarafından korunmuş olarak ve tümüyle katlanmamış bir şekilde geçerler. Mitokondri içindeki şaperonlar, polipeptid zincirinin zardan geçip organel içerisinde katlanmasını kolaylaştırırlar. Ayrıca, çoklu polipeptid zincirinden oluşan proteinlerin ve makromoleküler yapıların bir araya gelmesine de katılırlar.
Moleküler şaperon olarak iş gördüğü bilinen proteinlerin çoğu başlangıçta ısı-şok proteinleri (heat-shock proteins) olarak tanımlanan hücrelerde, çevresel stres ve yüksek sıcaklıkta eksprese edilen bir protein grubudur. Isı-şok proteinleri (Hsp) yüksek sıcaklıkta karşılaşma sonucunda, kısmen denatüre olan proteinleri korur ve tekrar katlanmasını kolaylaştırır. Şaperon proteinlerinin iki ailesi Hsp70 ve şaperoninler, ökaryot ve bakteri hücrelerinin genel protein katlanma yolaklarında özellikle önemlidir.
Her iki ailenin proteinleri polipeptid zincirlerinin katlanmamış bölgelerine bağlanarak iş görür. Hsp70 ve şaperonin ailesi üyeleri bakterilerin ve ökaryotik hücrelerin sitozollerinde ve hücre içi organellerinde (endoplazmik retikulum, mitokondri ve kloroplast) bulunurlar. Hsp70 ailesinin üyeleri polipeptidlerin, endoplazmik retikulum ve mitokondri gibi çeşitli hücresel kompartmanlara taşınmasında olduğu kadar, translasyon sırasında yeni sentezlenen, katlanmamış polipeptid zincirlerini stabilize ederek de görev yapar. Bu proteinler, katlanmamış polipeptidlerin kısa hidrofobik bölgelerine (yaklaşık yedi amino asitlik) bağlanarak, onları bu katlanmamış konfigürasyonda tutar ve kümelenmelerini önlerler.
/old/content_media/e9f46ebfeb914acda9e6d34dd0520849.jpg)
Katlanmamış polipeptid zinciri daha sonra Hsp70 şaperondan doğru protein katlanmasının gerçekleşeceği ve proteinin üç boyutlu fonksiyonel konformasyona ulaşacağı şaperonine transfer edilir. Şaperoninler iki bölmeli yapı oluşturmak üzere üst üste iki halka şeklinde düzenlenmiş çok sayıda protein alt biriminden oluşur. Bu izole ortamda katlanmamış polipeptid zincir bölgelerinin diğer katlanmamış polipeptid zincirleri ile kümelenmesini engelleyerek protein katlanmasına devam eder.
Bakteri ve ökaryot hücrelerde ilave şaperon aileleri bulunur ve şaperon sayısı ökaryotlarda göreceli olarak daha fazladır. Örneğin, ökaryot hücrelerde bazı proteinlerin katlanması için alternatif yolaklar Hsp70 ve Hsp90 ailesi üyelerinin bir dizi etkileşimini içerir. Hsp90 tarafından katlanma substratları, steroid hormon reseptörleri ve çeşitli protein kinazlar dahil olmak üzere sinyal iletimi ile ilgili proteinlerdir.
Protein Katlanmasını Katalize Eden Enzimler
Kısmen katlanmış ara ürünlere bağlanıp stabilize ederek protein katlanmasını kolaylaştıran şaperonlara ilave olarak hücreler, protein katlanmasını katalizleyen en az iki tip enzim bulundururlar. Birçok proteinin katlanmış yapısının kararlı hale gelmesinde, sistein amino asitleri arasındaki disülfit bağının oluşumu önemlidir. Protein disülfit izomeraz (PDI), disülfit bağlarının oluşumunu katalizler.
Çok sayıda sistein içeren proteinler için, protein disülfit izomeraz disülfit çiftleri arasında hızlı değişimi artırarak önemli rol oynar, böylece proteinin en kararlı konformasyonu ile uyumlu disülfit düzenine erişmesine imkan verir. Disülfit bağları genellikle salgılanan proteinler ve zar proteinleri ile sınırlıdır, çünkü sitozol sisteinleri indirgenmiş formunda (-SH) tutacak redükleyici ajanlar içerir ve böylece disülfit (S-S) bağı oluşumu engellenir. Ökaryot hücrelerde disülfit bağları, içinde oksitleyici ortamın bulunduğu endoplazmik retikulumda oluşur. PDI endoplazmik retikulumda bulunan çok önemli bir katalist ve şaperon olup bu organelde en fazla bulunan proteindir.
/old/content_media/a5688ee535f7d8fbc310e594025e6c78.jpg)
Protein katlanmasında rol oynayan ikinci enzim prolinlerin katıldığı peptid bağlarının izomerizasyonunun katalizler. Prolin, peptid bağlarının cis ve trans konformasyonunu eşit dağılımdan biraz daha trans forma geçmesini tercih ettiren sıra dışı bir amino asittir. Buna karşılık, diğer amino asitler arasındaki peptit bağları hemen her zaman trans formdadır. Proteinlerin katlanmasında hız sınırlayıcı aşama olma özelliği taşıyan prolil-peptid bağlarının sis ve trans konfigürasyonları arasındaki izomer dönüşümü peptidil prolil izomeraz enzimi tarafından katalizlenir. Bu enzim prokaryot ve ökaryotlarda yaygın olarak bulunur ve bazı proteinlerin katlanmasında önemli rol oynar.
/old/content_media/38fe3f61e3b5ffce63ef115f4c9a0477.jpg)
Protein Kesimi
Birçok proteinin olgunlaşmasında polipeptid zincirinin kesilmesi (proteoliz) önemli bir aşamadır. En basit örnek, ribozomda oluşmaya başlayan polipeptidin amino terminalindeki başlatıcı metiyoninin polipeptidden uzaklaştırılmasıdır. Daha sonra, amino ucuna genellikle asetil grubu ve yağ asidi zinciri gibi kimyasal grupların eklenmesi gerçekleşir.
Amino ucunun proteolitik modifikasyonu, bakterilerde ve ökaryotlarda salgı proteinleri ile, ökaryotlarda plazma zarına, lizozoma, mitokondriye ve kloroplastlara katılacak proteinlerde olduğu gibi, zarı geçecek birçok proteinin translokasyonunda da önemli rol oynar. Bu proteinler, gidecekleri yere, amino ucu sinyal dizileri sayesinde iletildikten sonra, amino terminal dizileri proteolitik kesimle uzaklaştırılır. Örneğin, yaklaşık 20 amino asit uzunluktaki bu amino terminal sinyal dizileri, daha translasyon devam ederken, salgılanacak proteinleri ökaryotlarda endoplazmik retikuluma veya bakteri plazma zarına hedefler.
Çoğunlukla hidrofilik amino asitlerden oluşan sinyal dizileri, ribozomda sentez aşamasında membran kanallarına girer. Polipeptid zincirinin kalan kısmı ise, sentez ilerledikçe membran kanalına geçer. Daha sonra sinyal dizi, özgül bir membran proteazı tarafından (sinyal peptidaz) kesilir ve olgun protein serbest kalır. Ökaryot hücrelerde sentezlenen polipeptit zincirinin endoplazmik retikuluma aktarılması, proteinlerin salgılanması, plazma zarına ya da lizozoma katılmak için hedeflenmesindeki ilk aşamadır.
Proteolitik işlenmeye diğer bir önemli örnek de, aktif enzim veya hormonların daha büyük öncüllerinden kesimle oluşmalarıdır. Büyük bir öncül polipeptid olarak sentezlenen insülin iyi bir örnektir. İnsülin kesim ile yapılır. Başlangıç öncülü (preproinsulin) polipeptidi endoplazmik retikuluma hedefleyen bir amino ucu sinyal dizisi taşır. Endoplazmik retikuluma transfer sırasında sinyal dizilerin uzaklaştırılması proinsülin adı verilen ikinci öncülü verir. Bu öncül daha sonra, aradaki bir peptid grubunun proteolitik uzaklaştırılması ile insüline çevrilir. Kanın pıhtılaşması, sindirim enzimleri ve hayvanlarda programlı hücre ölümünü düzenleyen proteaz serileri gibi diğer proteinler de benzer kesim süreçleri ile aktive olurlar.
Birçok hayvan virüsünün proteinlerinin de büyük öncüllerden kesimle türetilmeleri ilginçtir. Proteoliz işleminin virüs replikasyonunda özellikle önemli olduğunu gösteren bir örnek HIV’den gelmektedir. HIV’in replikasyonunda virüs tarafından kodlanan bir proteaz viral yapısal proteinleri öncül polipeptidi oluşturmak üzere keser. Virüs replikasyonundaki temel rolü ile HIV proteaz, AIDS tedavisinde kullanılmak üzere ilaç geliştirilmesinde önemli bir hedeftir. Gerçekte de bu proteaz inhibitörleri bu hastalık ile savaşta kullanılan ajanlar içinde en etkin olanlardan biridir.
Glikosillenme
Birçok protein, özellikle ökaryot hücrelerde glikosillenme adı verilen bir süreçte karbonhidrat eklenerek değiştirilir. Birçok nükleer ve sitoplazmik protein de glikozillenme ile birlikte, karbonhidrat zincirinin eklendiği proteinler glikoproteinler olarak adlandırılır ve genellikle salgılanır veya hücre yüzeyinde yer alır. Glikoproteinlerin karbonhidrat kısımları endoplazmik retikulumda protein katlanmasında, proteinlerin uygun hücresel bölgelere hedeflemesinde ve hücre-hücre etkileşim bölgelerinin tanınmasında önemli rol oynar.
Glikoproteinlerin çoğu karbonhidrat yan gruplarının takılma bölgesine bağlı olarak N-bağlı veya O-bağlı olarak sınıflandırılır. N-bağlı glikoproteinlerde karbonhidrat, asparajin yan grubundaki nitrojen atomuna takılır. O-bağlı glikoproteinlerde, treonin veya serin yan grubundaki oksijen atomu karbonhidrat için takılma bölgesidir. Bu pozisyonlara doğrudan bağlanan şekerler genellikle N-asetilglukozamin veya N-galaktozamindir. İlave olarak, mannoz birimleri bazı proteinlerdeki triptofan kalıntılarına karbon-karbon bağı ile bağlanır.
Glikozilasyon proteinlere; doğrudan biyolojik aktivite kazandırır, hedeflemesinde anahtar rol oynar, reseptör-ligand tanınmasında önemli rol üstlenir, kararlılığının ve suda çözünürlüğün artmasında önemlidir.
/old/content_media/29bbe7af039a13c1def21ca44ee89398.jpg)
Proteinlere Lipidlerin Takılması
Ökaryotik hücrelerde bazı proteinler polipeptit zincirine lipid takılması ile modifiye olurlar. Hidrofobik lipidler zarlarla etkileşebildikleri için bu değişiklikler, proteinleri plazma zarına yönlendirir ve yerleştirir. Plazma zarının sitozolik yüzü ile ilişkili olan ökaryot proteinlerinde N-miristillenme, prenillenme ve palmitillenme olmak üzere üç genel tipte lipid eklentisi yaygındır. Dördüncü bir modifikasyon glikolipidlerin ilavesidir - ki hücre yüzey proteinlerini, plazma zarının hücre dışına bakan yüzüne yerleştirmede önemli rol oynar.
Bazı proteinlerde, proteine translasyon sırasında uzamakta olan polipeptid zincirinin amino ucuna bir yağ asidi takılır. N-miristillenme olarak adlandırılan bu işlemde, miristik asit (14 karbonlu bir yağ asidi) bir glisin eklentisinin N-ucuna takılır. N-miristillenerek değişen birçok protein plazma zarının iç yüzü ile ilişki halindedir ve bu ilişkide yağ asitlerinin rolü, N-ucu glisinin, alanin ile değiştiği mutant proteinlerinin analizi ile gösterilmiştir. Bu yer değiştirme miristillenmeyi önler ve proteinin zar ile ilişkisini inhibe ederek mutant proteinlerin fonksiyonlarını bloklar.
Lipidler sistein, serin ve treonin amino asitlerinin yan zincirlerini de bağlanabilir. Bu tipte modifikasyonun önemli bir örneği prenillenmedir. Burada özgül tipte lipidler (prenil gruplar), polipeptid zincirinin C-ucuna yakın bölgede yerleşik sisteinlerin yan zincirlerindeki kükürt atomuna bağlanırlar. Çeşitli insan kanserlerindeki kontrolsüz çoğalmadan sorumlu olan Ras onkogen proteini de dahil olmak üzere, hücre çoğalma ve farklılaşmasının kontrolüne katılan plazma zarı ile ilişkili birçok protein bu şekilde modifiye olur.
Üçüncü bir yağ asidi modifikasyon tipi, 16 karbonlu bir yağ asidi olan palmitik asidin iç sistinlerin yan grubundaki kükürt atomlarına eklenmesiyle gerçekleşen palmitillenmedir. N-miristillenme ve prenillenme gibi, pamitillenme de bazı proteinlerin plazma zarının sitozolik yüzüne bağlanmasında önemli rol oynar.
Son olarak, oligosakkaritlere bağlı lipidler (glikolipidler), bazı proteinlerin C-ucu karboksil grubuna eklenerek, bu proteinlerin plazma zarının dış yüzeyine yerleşmesini sağlanır.
Protein Fonksiyonlarının Düzenlenmesi
Proteinlerin en önemli işlevlerinden biri, tüm biyolojik reaksiyonların katalizi için gerekli olan, enzim aktiviteleridir. Bu yüzden enzim aktivitesinin düzenlenmesi, hücre davranışlarını belirlemede anahtar rol oynar. Hücre bunu kısmen sentezlenecek enzim (protein) miktarını belirleyerek gen ekspresyonu düzeyinde başarır. Daha ileri düzeyde bir kontrol ise proteinlerin sadece miktarını değil aynı zamanda aktivitelerini kontrol etmeye imkan veren protein işlevinin denetimi ile sağlanır.
Küçük Moleküllerle Düzenlenme
Enzimlerin çoğunun katalitik aktiviteleri, konformasyon değişimleri ile kontrol edilmektedir. Birçok durumda bu konformasyonel değişim enzim aktivitesini düzenleyen nükleotidler veya amino asitler gibi küçük moleküllerin bağlanması sonucunda ortaya çıkar. Bu tip düzenlenme genellikle, geri besleme (feedback) inhibisyonu yoluyla kontrolden sorumludur.
Örneğin, biyosentez yolakların bir çoğunda, son ürün (örn.,amino asitler) kendi sentez yolağındaki ilk basamağı katalizleyen enzimi inhibe eder, böylece gereksiz miktarda sentezi önleyerek yeterli miktarda ürün sağlanmasını garantiler. Geri Besleme inhibisyonu, enzimin katalitik bölgesi dışında bir yere düzenleyici molekülün bağlanması ile ortaya çıkan allosterik düzenlemeye örnektir. Bunun gibi düzenleyici moleküllerin bağlanması, proteinin üç boyutlu yapısını değiştirir ve böylece, katalitik bölgenin şekli değiştiği için katalitik aktivite etkilenir.
Birçok hücresel protein GTP veya GDP bağlanması ile düzenlenir. Bu proteinler arasında, hücre çoğalmasının kontrolü ve insan kanserlerindeki rolü nedeni ile yoğun bir şekilde çalışılan, Ras onkogen proteini de bulunur. Bu proteinlerin X-ışını kristalografisi, GTP-bağlı aktif ve GDP-bağlı inaktif biçimleri arasında, küçük fakat fonksiyonel olarak çok önemli farklar olduğunu açığa çıkarmıştır.
Protein konformasyonundaki bu küçük farklılık, Ras’ın hücre bölünmesini uyaran hedef molekülle etkileşip ekileşemeyeceğini belirlemektedir. Proteinin üç boyutlu şeklindeki bu küçük farklılığın önemi, ras genindeki mutasyonların insan kanserlerinin %25’inin gelişimine katkıda bulunduğu gerçeği ile çarpıcı şekilde göstermektedir. Böyle mutasyonlar Ras proteinin konformasyonunu öyle değiştirir ki, protein GTP-bağlı aktif konformasyona kilitlenir ve sürekli bölünme sinyali ileterek kanser hücrelerinin kontrolsüz bölünmesine yol açar.
Protein Fosforillenmesi
Birçok proteinin işlevi kovalent modifikasyonlar ile düzenlenir. Bu tipte düzenlemenin bir örneği, bazı enzimlerin inaktif öncüllerinin proteolitik kesim ile aktivasyonudur. Proteoliz geri dönüşümsüz olduğu için, enzim aktivitesini çevresel değişimlere cevap olarak açıp kapamak yerine, enzim aktivasyonunun kontrolünü sağlar. Buna karşılık diğer kovalent değişimler özellikle fosforillenme-allosterik düzenleme de olduğu gibi kolayca geri dönüşebilir ve çevresel sinyallere cevap olarak çok çeşitli hücresel proteini, geri dönüşümlü bir şekilde, aktive veya inhibe eder.
Protein fosforillenmesi, fosfat grubunu ATP’den serin, treonin veya tirozinin yan zincirlerindeki hidroksil grubuna transfer eden protein kinazlar tarafından katalizlenir. Protein fosforilasyonu fosfatlanmış amino asitlerin hidrolizini katalizleyen protein fosfatazlar tarafından geri dönüştürülebilir. Bazı protein fosfatazlar her üç amino asidi tanımakla birlikte, fosfatazların çoğu, protein kinazlar gibi, serin, treonin veya tirozine özgüldür.
Protein-Protein Etkileşimi
Proteinlerin çoğu, her biri bağımsız polipeptid zinciri olan birden fazla alt birimden oluşur. Bazı proteinlerde bu alt birimler özdeştir, diğerleri ise iki ya da daha fazla birbirinden farklı alt birimden oluşurlar. Her iki durumda da, polipeptid zincirleri arasındaki ilişki protein aktivitelerinin düzenlenmesi için önemlidir.
Protein Yıkımı
Hücre içindeki proteinlerin düzeyi sadece onların sentez hızı ile değil aynı zamanda yıkım hızı ile de kontrol edilir. Proteinlerin hücre içindeki yarı ömrü, dakikalardan birkaç güne kadar büyük değişim gösterir ve protein yıkım oranlarındaki farklılık hücre düzenlenmesindeki önemli kavramlardan biridir. Özgül sinyallere cevap olarak çabuk yıkılan proteinler, hücre içi enzim aktivitesinin düzenlenmesi için diğer bir mekanizma oluşturur. Ek olarak, hücre içindeki hatalı veya hasarlı proteinler süratle tanınır ve yıkılır, böylece, protein sentezi sırasında oluşan hatalar süratle uzaklaştırılmış olur. Ubikitin-proteazom ve lizozomal proteoliz olmak üzere protein yıkımını sağlayan iki ana yol vardır.
Übikütin-Proteazom Yolağı
Ökaryot hücrelerde, en önemli, seçili protein yıkım yolu, sitozolik ve nükleer proteinleri süratle yıkabilmek için übikütin belirleyici olarak kullanır. Proteinler, E3’ler ile katalize edilen çoklu ubikütin zincirlerini oluşturmak üzere ek übikütinler eklenerek yıkım için işaretlenebilirler. Bu şekilde çok sayıda übikütin eklenmiş proteinler, proteazom adı verilen çok alt birimli proteaz kompleksi tarafından tanınır ve yıkılır. Gen ekspresyonu ve hücre çoğalması gibi temel hücresel süreçleri kontrol eden proteinler, kontrollü übikütinlenme ve proteoliz için hedeflerdir.
Lizozomal Proteoliz
Ökaryot hücrelerde diğer bir majör yıkım yolu proteinlerin lizozomlar tarafından alınması ile gerçekleşir. Lizozomlar, çeşitli proteazların da dahil olduğu bir seri sindirim enzimlerini içeren, zarla çevrili organellerdir. Sitozolik proteinler ve sitoplazmik organellerin yıkılması ve endositozla alınan hücre dışı proteinlerin sindirimi de dahil olmak üzere, hücre metabolizmasında çeşitli rolleri vardır.
Proteazlar ve diğer sindirim enzimlerinin lizozomda tutulması hücre bileşenlerinin kontrolsüz bir şekilde yıkımını önler. Bu nedenle lizozomal proteoliz ile yıkım için hücresel proteinler önce lizozomlar tarafından alınması gerekmektedir. Hücresel proteinlerin alımında ki başlıca yolak, otofaji’dir. Bu süreç büyük olasılıkla endoplazmik retikulum zarından çıkan, bir miktar sitoplazma ve sitoplazmik organel içeren veziküllerin (otofagozomlar) oluşumunu gerektirir. Bu veziküller daha sonra lizozomlar ile birleşir ve içindekiler lizozomal enzimler tarafından sindirilir. Hücre proteinlerinin saatte yaklaşık %1’i bu mekanizma ile yıkılmaktadır.
Otofaji genellikle açlık sırasında aktive olmaktadır, böylece hücre gerekli olmayan protein ve organelleri yıkarak onların bileşenlerini tekrar tekrar kullanıma sokar. Ek olarak otofaji, yeniden doku şekillenmesi ve hücresel bileşenlerin yıkımını içeren böcek metamorfozu gibi, birçok gelişim süreçte de önemli rol oynar. Otofaji aynı zamanda programlı hücre ölümünde de önemli rol oynar ve otofaji hataları kanser ve nörodejeneratif hastalıklar olmak üzere çeşitli insan hastalıkları ile ilişkilendirilmiştir.
Protein Tasnifi: Proteinler Görev Yerlerine Nasıl Gönderilir?
Endoplazmik Retikulum ve Protein Taşınması
Ökaryot hücrelerin karmaşık iç organizasyonları göz önüne alındığında, proteinlerin sınıflandırılması ve doğru hedeflere taşınması oldukça önemli görevlerdir.
Translasyon sürerken, sentezlenen polipeptit zincirleri protein katlanması ve işlenmesi için, E.R. içine transfer edilir. ERden veziküller aracılığı ile golgi aygıtına taşınırlar ve burada işlenip son halini alarak, lizozomlara, endozomlara, hücre zarına taşınmak veya hücreden salgılanmak üzere paketlenirler.
Protein Salgılanması
Salgılanan proteinlerin izledikleri yol, salgı yolağı: granüllü ER—Golgi—Salgı Vezikülleri—Hücre Dışı olarak tamamlanır.
Salgılanacak veya ER, Golgi aygıtı, lizozomlar, nükleer membran, peroksizom ve plazma zarına hedeflenen ya da, bu organellerin yapısına katılacak proteinler, öncelikle ER’ye hedeflenir. Memeli hücrelerinde, çoğu protein zara bağlı ribozomlar üzerinde sentezlenirken ER içine taşınırlar. Buna karşın sitoplazma içinde serbest kalacak veya mitokondri, kloroplast, peroksizom yapısına katılacak proteinler serbest ribozomlarda sentezlenir ve protein sentezi bittiğinde sitoplazma içine bırakılırlar.
Proteinlerin Endoplazmik Retikuluma Hedeflenmesi
Proteinler, ER’ye bağlı ribozomlar üzerinde sentezleri sürerken ER içine taşınabildikleri gibi, sitozoldeki serbest ribozomlar üzerinde sentez tamamlandıktan sonra da ER içine alınabilirler. Translasyon sırasında aktarım yolunun ilk basamağı, ribozom-mRNA kompleksinin ER’ye tutulmasıdır. Ribozomlar kendilerinde bulunan bir özellikten dolayı değil, sentezlenen polipeptit zincirindeki dizilerle ER’ye hedeflenirler.
Serbest ve zara bağlı ribozomlar işlevsel olarak birbirlerinden farksızdırlar ve protein sentezi genellikle sitozolde serbest olarak bulunan ribozomlardan başlar. Salgılanacak proteinlerin sentezlendiği ribozomlar, uzayan polipeptid zincirinin amino ucunda bulunan bir sinyal dizi aracılığı ile ER’ye hedeflenirler. Bu sinyal dizileri hidrofobik amino asitlerden oluşan kısa diziler olup, ER lümenine aktarım sırasında polipeptid zincirinden kesilerek uzaklaştırılırlar.
/old/content_media/d3a6a10cfbeb03a8754a306a7bb3e112.jpg)
Sinyal dizi, yaklaşık 15-40 amino asit uzunluğunda olup, 7-12 hidrofobik amino asitlik bir bölge içerir ve genellikle polipeptid zincirinin amino ucunda yer alır. Altı polipeptid ve bir küçük sitoplazmik RNA’dan (SRP RNA) oluşan sinyal tanıyan partikül (SRP), bu sinyal dizilerini, henüz ribozomlarda sentezleri sürerken tanır ve bağlanır. SRP, sinyal dizisi ile birlikte ribozoma da bağlanarak translasyonun daha fazla ilerlemesini durdurur ve granüllü ER zarında bulunan SRP reseptörüne bağlanarak tüm kompleksin ER’ye hedeflenmesini sağlar. Reseptöre bağlanma, SRP’nin ribozomdan ve uzayan peptid zincirinin sinyal dizisinden ayrılmasını sağlar. Bu aşamada ribozom ER zarında bulunan bir protein translokasyon kompleksine bağlanır ve sinyal dizisi bir zar kanalının –translokon- içine sokulur.
ER’deki translokonlar, hem maya hem de memeli hücrelerinde Sec61 proteinleri adı verilen üç transmembran proteinden oluşmuş komplekslerdir. Maya ve memeli translokon proteinleri, bakteri plazma zarında salgılanan polipepdtidlerin translokasyonundan sorumlu proteinlere büyük benzerlik gösterir ki bu da protein salgı mekanizmalarının ökaryot ve prokaryot hücreler arasındaki dikkat çekici korunumuna işaret eder. Ribozomun SRP’den translokona aktarılması, baskılanmış olan çevrimin kaldığı yerden devam etmesini sağlar ve uzayan polipeptid zinciri doğrudan translokon kanalı yoluyla ER zarından iç boşluğa geçer. Translokasyon gerçekleştikçe, sinyal dizisi bir sinyal peptidaz enzimi tarfından kesilir ve polipeptid ER lümenine bırakılır.
Mayadaki pek çok protein gibi, memelilerdeki bazı proteinler de, ER zarına bağlı ribozomlar ile sentezlenirken değil, protein sentezi tamamladıktan sonra ER’ye hedeflenirler. Bu proteinlerin translasyon sonrasında ER’ye aktarılmaları için SRP gerekli değildir. Bunun yerine, polipeptidin sinyal dizileri ER üzerindeki translokonlarla ilişkili farklı reseptör proteinler (Sec62/63 kompleksi) tarafından tanınır. Sitozolde bulunan Hsp70 ve Hsp40 şaperonları, polipeptid zincirlerini katlanmamış konformasyonda tutmak için gereklidir. Böylece bu proteinler translokona girebilir.
Proteinlerin Endoplazmik Retikulum Zarına Katılması
Hücreden salgılanmak veya ER lümeni, Golgi aygıtı veya lizozomlarda yerleşmek üzere hedeflenen proteinler ER zarından geçerler ve ER lümeninde serbest kalırlar. Ancak, plazma zarına veya diğer bölmelerin zar yapılarına katılacak olan proteinler, ER lümenine geçmek yerine, ER zar yapısına katılır. Bu aşamadan sonra hedef yerlerine salgı proteinleri ile aynı yolu izleyerek giderler: ER—Golgi—Plazma zarı veya endozom—lizozom.
Pek çok protein yukarıda tarif edilen SRP/Sec61 ko-translasyonel yolak ile ER zar yapısına katılır. Proteinlerin çoğu, SRP tarafından tanınarak translokona getirilen internal transmembran diziler ile ER zarına doğrudan yerleştirilir, fakat bu diziler sinyal peptidazlar tarafından kesilerek uzaklaştırılamaz. Bunun yerine, bu transmembran α heliksler translokondan lateral yönde çıkarak proteini ER zarının içine çapalar. Bu translokon için bir değişiklik sinyali oluşturarak, translokon yapısındaki transmembran heliksin açılmasını ve proteinin hidrofobik transmembran domainin translokondan çift katlı lipid zarın içine çıkmasını sağlar. Burada önemli bir nokta da amino veya karboksil ucun translokondan geçişini sağlayabilecek şekilde sinyal dizisinin yerleşimidir.
Endoplazmik Retikulumda Protein Katlanması ve İşlenmesi
Proteinin işlenme olaylarından biri, polipeptid zincir ER zarından geçerken gerçekleşen sinyal peptidin proteolitik kesimidir. Buna ek olarak ER, protein katlanmasının gerçekleştiği, çoklu alt birime sahip proteinlerde alt birimlerin bir araya geldiği, disülfid bağlarının oluştuğu, N-glikozillenmenin gerçekleştiği ve bazı plazma zar proteinlerine glikolipid çapaların eklendiği yerdir. Hatta, lümendeki ER proteinlerin birincil işlevi, içeriye yeni alınmış polipeptid zincirlerinin katlanmasında ve bir araya getirilmesinde görev almaktır.
Önceden söylendiği gibi, proteinler translasyon sürerken katlanmamış polipeptid zincirleri olarak ER zarından lümen içine aktarırlar. Bu polipeptidler katlanmayı düzenleyen moleküler şaperonlar yardımıyla üç boyutlu yapılarına ER içinde katlanırlar. Bir Hsp70 şaperonu olan BiP’in, katlanmamış polipeptit zincirine, zarı geçerken bağlandığı ve sonra protein katlanması ile alt birimlerin birleştirilmesi ER içinde düzenlendiği düşünülmektedir. Doğru yapılandırılmış proteinler BiP’den ve diğer şaperonlardan ayrılarak Golgi aygıtına aktarılırlar.
Sistein birimlerinin yan zincirleri arasında disülfid bağlarının oluşumu, ER içindeki protein katlanma ve yapılanmasının önemli bir aşamasıdır. Bu bağlar, indirgen bir çevre olan ve sistein amino asitlerini indirgenmiş formda (-SH) tutan sitozolde oluşmaz. ER’deki oksitleyici ortam disülfid bağ (S-S) oluşumunu destekler ve ER’de oluşmuş disülfid bağları, salgılanan ve hücre yüzey yapısında bulunan proteinlerin yapısında önemli rol oynar. Disülfid bağ oluşumu ER lümeninde yerleşik protein disülfid izomeraz (PDI) enzimi ile gerçekleşir.
Proteinler ayrıca, translasyonları sürerken ER içinde, bazı özel asparajin birimlerinden glikozillenirler (N-bağlı glikozillenme). Uzayan polipeptid zincirleri ER zarından lümene geçerken asparajin birimlerine 14 şeker birimden oluşan oligosakkarid birimleri eklenir. Glikolizasyon hem ER içerisinde protein agregasyonunun önlenmesinde, hem de salgı yolağında proteinlerin hedeflenmesi için gerekli sinyallerin sağlanmasında rol oynar.
Bazı proteinler plazma zarına transmembran bölgeleriyle değil, glikolipidler aracılığıyla sabitlenir. Yapıları zara ‘’çapa atabilen’’ glikolipidler, fosfatidilinositol içerdiklerinden glikosilfofastidil inozitol (GPI) çapaları olarak adlandırılırlar. GPI çapaları, ER zarı içinde yapılandırılırlar. Protein sentezinden hemen sonra karboksi terminalde bulunan hidrofobik bir bizi ile zara sabitlenmiş olan bazı proteinlerin hidrofobik C-ucu, GPI çapası ile değiştirilir. GPI çapasına sahip proteinlerin ER içindeki yönlenimleri, hücrenin dış yüzeyine yerleşeceklerini gösterir. GPI çapası, proteinin zar ile olan bağlantısından sorumludur.
Endoplazmik Retikulum'da Kalite Kontrolü
ER içerisinde sentezlenen proteinlerin büyük bir kısmı yıkıma uğramaktadır. Bunun başlıca sebebi proteinlerin doğru bir şekilde katlanmamış olmasıdır. ER içerisinde gerçekleşen protein katlanma süreci hem yavaş hem de verimsizdir. Pek çok protein işlev göreceği doğru katlanmış formlarına uğraşamazlar. Böyle yanlış katlanmış proteinler önce tanındıkları, daha sonra ubikitin proteozom sistemince yıkılmak üzere ER’den sitozole aktarıldıkları, ER ilişkili (ER-associated degradation: ERAD) olarak bilinen bir süreç ile ortadan kaldırılırlar.
ER lümeninde bulunan şaperon ve protein işleme enzimleri protein katlanmasında görev aldıklarından, çoğu kez yanlış katlanmış proteinlerin tanınmasından da sorumludurlar. İyi tanımlanmış glikoprotein katlanma yollarının birinde, ER lümeninde yerleşik kalneksin ve ER zarında yerleşik kalretikulin rol oynar. Bir peptidil prolil izomeraz ve protein disülfid izomeraz enzimleriyle birlikte kalneksin ve kalretikülin, glikoprotein doğru üç boyutlu yapısına katlanmasına yardımcı olur. Daha sonra oligosakkaritin ucundaki üçüncü glikoz molekülünün ayrılmasıyla glikoprotein serbest hale gelir. Bu glikoproteinin tam ve doğru katlandığını kontrol eden bir protein-katlanma algılayıcı molekül tarafından tanınmasını sağlar. Eğer doğru katlanma gerçekleşmişse, glikoprotein ER’yi terk ederek Golgi’ye doğru yolculuğuna devam eder.
Ancak glikoprotein doğru katlanmamışsa, katlanma algılayıcı molekül glikoz birimini oligosakkaride tekrar ekleyerek kalneksin ya da kalretiküline yeniden etkileşmesine ve doğru katlanma için ikinci denemede bulunmasını sağlar. Tekrarlayan döngülerden sonra halen doğru katlanamaya ve/veya düzeltilemeyecek kadar yanlış katlanmış glikoproteinler ise yıkım için ERAD yolağına hedeflenirler. Yanlış katlanmış protein, oligosakkaridlerden mannoz birimlerini ayıran, EDEM1 adında bir enzim tarafından tanınır. Mannoz birimlerinin koparılması proteinin kalneksin veya kalretikuline geri gönderilmesini önler ve yanlış katlanmış proteinler, ubikitin ligaz aktivitesi bulunan bir transmembran kompleksine aktarılırlar. Bu kompleks yoluyla ubikitinlendikleri ve proteozomda yıkıma uğradıkları sitozole geri gönderilirler.
ER’nin protein katlama kapasitesi ile hücrenin fizyolojik ihtiyaçlarını koordine edebilmek için, katlanmamış protein düzeyi sürekli izlenir. Bu süreç, ER içerisinde katlanmamış protein birikimi ile aktive olan katlanmamış protein yanıtı (unfolded protein response: UPR) olarak bilinen bir sinyal yolağı tarafından düzenlenir. Katlanmamış protein yanıt yolağını aktivasyonu, ER’nin genişlemesine, artan ihtiyacı karşılamak için ek şaperon yapımına ve bunlara ek olarak da yeni sentezlenen proteinlerin ER’ye geçiş düzeyinin geçici olarak azaltılmasına yol açar. Bu değişikliklerin ER’deki katlanmamış protein düzeyini normale çekememesi halinde, katlanmamış protein yanıt yolağının aktivasyonu programlanmış hücre ölümünü tetikler. Böylelikle sentezlenen proteinleri doğru katlayamayan hücreler ortadan kaldırılır.
Proteinin Endoplazmik Retikulum'dan Çıkışı
Proteinler bir zardan tomurcuklanıp diğeriyle kaynaşan taşıyıcı vezikül ile iletilirler. Bu moleküller ER’in özelleşmiş bir bölgesi olan ER çıkış bölgesinden (ERES) tomurcuklanarak çıkış yaparlar. Tomurcuklanan bu veziküller, birbirleriyle kaynaşarak ER-Golgi ara kompartmanını (ERGIC) oluştururlar ve buradan proteinleri Golgi aygıtına aktarırlar. ER zarının sitozolik yüzeyinde yer alan bir protein bölgesi, aynı şekilde Golgi ve plazma zarlarının da sitozolik yüzeyinde yer alır, böylece bu bölgeler arasında protein alışverişi gerçekleştirilmiş olur.
ER’den Golgiye hedeflenen transmembran proteinler ER çıkış bölgelerinde veziküllere paketlenebilmelerini sağlayan çeşitli peptid ve karbonhidrat sinyal moleküllerini sergilerler. Benzer şekilde ER’den dışarı aktarılan çoğu luminal protein de seçici bir şekilde paketlenmiş transmembran proteinlere tutunmuş durumdadır.
ER içindeki işaretsiz proteinler de protein paketlenmesi için özel sinyallere ihtiyaç duymayan bir dizi taşıma yolağıyla Golgiye aktarılırlar. Sonuç olarak sadece salgılanacak proteinler değil, ER’de işlev gören proteinler de (örneğin lümendeki BiP, protein disülfid izomeraz gibi) taşıma veziküllerine paketlenip Golgi’ye aktarılabilir. Bu tür proteinlerin salgı yolağında ilerlemelerine izin verilirse hücre dışına geçecek ve hücreden kaybedileceklerdir. Bunu önlemek için, yerleşik ER proteinleri ER-Golgi ara kompartmanında tanınırlar ve kazanım yolağıyla ER’ye geri taşınırlar. Örneğin ER’de işlev görev birçok proteinin karboksil uçlarında, ER’de tutulmalarına ya da ER’ye geri kazanımlarını sağlayan bir Lys-Asp-Glu-Leu hedef dizisini barındırırlar. Bu diziler, proteinlerin hücre dışına salgılanmasına engel olur.
Proteinlerin Golgi Aygıtından Dışarı Gönderilmesi
Proteinler Golgi aygıtından, son yerleşim yerlerine salgı yolağı ile taşınırlar. Bu süreç proteinlerin, Golgi ağından tomurcuklanan farklı türlerdeki veziküllere dağıtılmasını ve vezikül içeriğini, uygun hücresel yerleşim yerine gönderilmesini kapsar. Bazı proteinler, doğrudan ya da endozomları bir ara basamak olarak Golgi’den plazma zarına taşınırlar. Diğerleri hücreden salgılanır. Diğer bazı proteinler de hayvan hücrelerinde geç lizozom, mayalarda vakuoller gibi başka hücre içi yerleşim yerlerine hedeflenirler.
Golgi aygıtında işlevi olan proteinler, salgı yolağında ilerlemek yerine bu organelin uygun bir bölümünde alıkonulmak zorundadır. Golgi’de tutulan çoğu protein, glikozilasyonda görevli transmembran proteinlerdir ve Golgi’de tutulmalarından sorumlu olan temel sinyal, transmembran ve sitoplazmik bölgelerinde bulunur.
/old/content_media/97f4afeb839e69c45923463ce48b0c46.png)
Golgi aygıtından hücre yüzeyine taşıma en az üç yolla gerçekleşir .En basit yol, proteinlerin sürekli salgılanmasını olanak veren, bunun yanı sıra plazma membranına protein ve lipitlerin eklenmesini de sağlayabilen, Golgi ağından hücre yüzeyine doğrudan taşımadır. Hücre ek olarak proteinler Golgi’den plazma zarına, hayvan hücrelerinde bulunan üç endozom türünden biri olan geri dönüşümlü endozomların bir ara formuyla da taşınabilirler.
Ek bir diğer salgı şekli de, bazı hücrelerde bulunan ve çevresel uyarılara yanıt olarak spesifik proteinlerin salgılanmasını sağlayan özel denetimli bir salgı yolağının kullanılmasıdır. Denetlenebilir salgı yolaklarına örnek olarak, endokrin hücrelerinden hormonların salınması, nöronlardan nörotransmitterlerin salınışı verilebilir.
Golgi içerisinde en iyi tanımlanmış protein tasnif ve taşınması, proteinlerin lizozoma seçici olarak hedeflenmesidir. Lümendeki lizozomal proteinler, Golgi aygıtına girdikten hemen sonra N-bağlı oligosakkaridlerindeki bir modifikasyon sonucu oluşan mannoz 6-fosfat ile işaretlenir. Sitozolik bölgelerinde reseptör-lizozomal enzim kompleksi, yönlendirme dizilerini içeren reseptörler taşıyıcı veziküllere paketlenerek daha sonra lizozomlara olgunlaşacak genç endozomlara hedeflenir.
Evrim Ağacı'nda tek bir hedefimiz var: Bilimsel gerçekleri en doğru, tarafsız ve kolay anlaşılır şekilde Türkiye'ye ulaştırmak. Ancak tahmin edebileceğiniz gibi Türkiye'de bilim anlatmak hiç kolay bir iş değil; hele ki bir yandan ekonomik bir hayatta kalma mücadelesi verirken...
O nedenle sizin desteklerinize ihtiyacımız var. Eğer yazılarımızı okuyanların %1'i bize bütçesinin elverdiği kadar destek olmayı seçseydi, bir daha tek bir reklam göstermeden Evrim Ağacı'nın bütün bilim iletişimi faaliyetlerini sürdürebilirdik. Bir düşünün: sadece %1'i...
O %1'i inşa etmemize yardım eder misiniz? Evrim Ağacı Premium üyesi olarak, ekibimizin size ve Türkiye'ye bilimi daha etkili ve profesyonel bir şekilde ulaştırmamızı mümkün kılmış olacaksınız. Ayrıca size olan minnetimizin bir ifadesi olarak, çok sayıda ayrıcalığa erişim sağlayacaksınız.
Makalelerimizin bilimsel gerçekleri doğru bir şekilde yansıtması için en üst düzey çabayı gösteriyoruz. Gözünüze doğru gelmeyen bir şey varsa, mümkünse güvenilir kaynaklarınızla birlikte bize ulaşın!
Bu makalemizle ilgili merak ettiğin bir şey mi var? Buraya tıklayarak sorabilirsin.
Soru & Cevap Platformuna Git- 8
- 7
- 5
- 4
- 3
- 2
- 1
- 1
- 0
- 0
- 0
- 0
- B. Mutlu. Proteinler. (10 Eylül 2014). Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: SlidePlayer | Arşiv Bağlantısı
- Scitable. Protein Function. Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: Nature | Arşiv Bağlantısı
- Quora. What Is The Difference Between N-Linked And O-Linked Glycosylation?. Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: Quora | Arşiv Bağlantısı
- J. D. Richter, et al. (2005). Regulation Of Cap-Dependent Translation By Eif4E Inhibitory Proteins. Nature, sf: 477-480. doi: 10.1038/nature03205. | Arşiv Bağlantısı
- R. J. Ellis. (1999). Molecular Chaperones: Pathways And Networks. Current Biology, sf: R137-R139. doi: 10.1016/S0960-9822(99)80082-7. | Arşiv Bağlantısı
- Medline Plus. What Are Proteins And What Do They Do?: Medlineplus Genetics. Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: Medline Plus | Arşiv Bağlantısı
- B. P. Y. Smith. Protein Structure And Function. Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: News-Medical | Arşiv Bağlantısı
- Genome. Translation. Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: Genome | Arşiv Bağlantısı
- N. Arıcan. Chaperone (Şaperon) Protein. (28 Ağustos 2020). Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: Gelecek Bilimde | Arşiv Bağlantısı
- Scitable. Translation / Rna Translation. Alındığı Tarih: 11 Ocak 2022. Alındığı Yer: Nature | Arşiv Bağlantısı
- G. M. Cooper. (2016). Hücre Moleküler Yaklaşım. ISBN: 9786056681714. Yayınevi: Ankara Nobel Tıp Kitabevleri.
- J. B. Reece. (2017). Campbell Biyoloji. ISBN: 9786053551478. Yayınevi: Palme Yayıncılık.
- J. D. Mauseth. (2012). Botanik: Bitki Biyolojisine Giriş. ISBN: 9786051333021. Yayınevi: Nobel Akademik Yayıncılık.
- B. Karaçay. (2010). Yaşamın Sırrı Dna. ISBN: 9789754035384. Yayınevi: TÜBİTAK Yayınları.
Evrim Ağacı'na her ay sadece 1 kahve ısmarlayarak destek olmak ister misiniz?
Şu iki siteden birini kullanarak şimdi destek olabilirsiniz:
kreosus.com/evrimagaci | patreon.com/evrimagaci
Çıktı Bilgisi: Bu sayfa, Evrim Ağacı yazdırma aracı kullanılarak 28/02/2026 20:42:06 tarihinde oluşturulmuştur. Evrim Ağacı'ndaki içeriklerin tamamı, birden fazla editör tarafından, durmaksızın elden geçirilmekte, güncellenmekte ve geliştirilmektedir. Dolayısıyla bu çıktının alındığı tarihten sonra yapılan güncellemeleri görmek ve bu içeriğin en güncel halini okumak için lütfen şu adrese gidiniz: https://evrimagaci.org/s/11316
İçerik Kullanım İzinleri: Evrim Ağacı'ndaki yazılı içerikler orijinallerine hiçbir şekilde dokunulmadığı müddetçe izin alınmaksızın paylaşılabilir, kopyalanabilir, yapıştırılabilir, çoğaltılabilir, basılabilir, dağıtılabilir, yayılabilir, alıntılanabilir. Ancak bu içeriklerin hiçbiri izin alınmaksızın değiştirilemez ve değiştirilmiş halleri Evrim Ağacı'na aitmiş gibi sunulamaz. Benzer şekilde, içeriklerin hiçbiri, söz konusu içeriğin açıkça belirtilmiş yazarlarından ve Evrim Ağacı'ndan başkasına aitmiş gibi sunulamaz. Bu sayfa izin alınmaksızın düzenlenemez, Evrim Ağacı logosu, yazar/editör bilgileri ve içeriğin diğer kısımları izin alınmaksızın değiştirilemez veya kaldırılamaz.
/old/profile_images/3ac3f7de6e5ff1f77ecb1b1ce0cd2dea.jpg)
/profile/37f26ac92b52d4b1fc6c287a2c379540.jpeg)
/profile/2aacbbe4-281f-4f73-9317-6cfea6fc8bc0.jpeg)
/evrimagaci.org/public/images/misc/feed-support-1.png)

/evrimagaci.org/public/images/logo-50.png)