Meyve Sineklerinde Beyin Gelişimi: İnsan Beyni ve İnsanlarda Beyin Gelişimi ile Benzerlikler
Meyve Sineklerinin Beyinlerine Bakarak, Kendi Beyinlerimizle İlgili Neler Öğrenebiliriz?
/old/content_media/1d9e6c69daccb0c01b61ba5d2c702971.jpg)
/profile/2aacbbe4-281f-4f73-9317-6cfea6fc8bc0.jpeg)
/old/profile_images/df6a49f318627461a3e9b697f2a2984e.jpg)
/profile/ccba17ab8634b9b2792d6d158f725c17.jpeg)
/profile/7c96ff4ed6bd1f43fcd3626ac02575b0.jpeg)
Bu Makalede Neler Öğreneceksiniz?
- İnsan ve Drosophila (meyve sineği) beyinlerinde nöronların asimetrik bölünme ile oluşumu, genler ve proteinlerin kutuplaşması sayesinde gerçekleşir ve bu süreç beyin gelişiminde kritik öneme sahiptir.
- Beynin gelişimi sırasında homeobox genleri gibi birçok gen, beynin farklı bölgelerinin oluşumunu düzenler ve bu genetik mekanizmalar evrimsel olarak türler arasında korunmuştur.
- Nöronların çoğalımının sonlanması, belirli genlerin işlevleri ve hücre içi mekanizmalarla kontrol edilir; bu süreçte hatalar beyin yapısında kusurlara ve tümör oluşumuna yol açabilir.
I. Giriş
Allen Beyinbilim Enstitüsü’nden Bilimsel Çalışmalar Şefi Dr. Christof Koch, “Beyin, bilinen evrendeki en karmaşık nesnedir.” der [1]. Son derece karmaşık olan beyin yapısı dünyasına giren kişinin hayret etmemesi mümkün değildir. İnsan beyninde 100 milyar kadar nöron vardır ve bunların her biri en az bir başka nöronla bağlantı kurar [2]. Bu bağlantılara sinaps denir. Beynin fazlasıyla girift olan bu yapısı, yüz milyonlarca bilgisayarı anlaşılması zor bir ağla birbirine bağlayan internete benzetilebilir. Tıpkı bir bilgisayarın kolayca bağlantısını değiştirip başka bir bilgisayarla iletişim kurabilmesi gibi nöronlar da tamamen dinamik bir şebeke oluştururlar. Komşu nöronlarla yaptıkları bağlantıları sürekli değiştirirler [3]. Hayvanların, özellikle de insanların görünürde basit, ancak gerçekte çok karmaşık davranışlarının arkasında bu vardır.
Beyin hakkında bilmediklerimiz hâlâ bildiklerimizden daha çoktur. Nöronlar sürekli farklı sinapslar oluştururken beynin değişik bölümleri nasıl hâlâ bu kadar uyumlu çalışabilir? Belleğimiz bilgileri ve anıları nasıl saklar? Elektrik sinyalleri nasıl canlı görüntülere, seslere, duygulara vs. dönüşür? Yine de beyin hakkında olağanüstü bir şey biliyoruz: Beyin, yaklaşık 500 milyon yıl önce solucanlarda evrimleşmiş ve o zamandan beri de evrimleşmeye devam eden bir organdır [4]. Beyin, hayvan evrimsel geçmişinin ilk evrelerinde ortaya çıktığından (genellikle beyni de içerecek şekilde) gelişmiş bir sinir sistemi olan modern türlerin çoğu beyni olan ortak bir atadan gelmektedir. Bu durum bize diğer türleri ve onların geçirdikleri evrimi inceleyerek kendi beynimizi anlama fırsatı verir.
Okuduğunuz dönem ödevinde bu yaklaşımla bir hikâye anlatılacak: Bir böcek beyninin gelişiminin büyüleyici öyküsü! “Bir böcek beyni mi?” diye sorabilirsiniz. Evet, daha açık olmak gerekirse, bir meyve sineği beyninin gelişimi. Böylesine küçük omurgasız bir hayvan, insan beyninin gelişimi ve evrimi hakkında, hayal edilemeyecek kadar saklı ayrıntıları su yüzüne çıkarabilir. Makalede ayrıca Drosophila ve Homo arasında bağlantı kurmak için diğer bazı türlerden de (özellikle bazı memelilerden de) söz edilecek; ancak meyve sineği ve insan genlerinin ve yolaklarının büyük bir kısmı ya tamamen aynı ya da homolog yapılara sahip olduğundan pek gerek duyulmayacaktır [5]. Drosophila beyni ve sinirsel gelişimi, memeli beyni gelişimini incelemede çok geçerli bir model olduğunu defalarca kanıtlaması açısından önemlidir [6]. Bununla birlikte şu da belirtilmelidir ki bu sürecin yarısı kadar bir kısmı, tek tek sineklerden bağımsız gibi görünse de kalan kısmı bireyden bireye dikkate değer ölçüde farklılık gösterir; bu da hayvanlar âleminde gördüğümüz davranış çeşitliliğine yol açar ve genelleştirme yapmayı (en azından araştırmanın ilk yıllarında) zorlaştırır [7]. Bununla beraber yıllar geçtikçe, evrimsel gelişim alanındaki teknolojik ilerleme ve yenilikler sayesinde, bu sorunların çoğunun üstesinden gelinmiştir. Bu makalede, çoğunlukla son araştırmalar dikkate alınacaktır, ancak gerektiğinde de daha eski çalışmalar kaynak gösterilecektir.
Bilinen evrendeki en karmaşık organ ve onun oluşumu, gelişimi ve hastalıkları üzerinde çalışmanın hiç de kolay bir iş olmadığı söylenmelidir. Ancak yine de evrendeki her anatomik yapı, karmaşıklığına bakılmaksızın, biyolojide “gelişme” denen “aşağıdan yukarıya yaklaşım” (oluşma) sürecinden geçmelidir. Kimi zaman bu gelişim sürecinde (apoptosis olayında olduğu gibi) “yukarıdan aşağıya yaklaşım” (eleme) görülebilir, ancak hiçbir karmaşık anatomik yapı birdenbire var olamaz [8]. Ya evrim sürecinden ya da gelişim sürecinden geçmelidir veya her ikisinden de. Beyin söz konusu olduğunda ise konuya tamamen hâkim olmak için her iki süreç de dikkate alınmalıdır. Beyin gelişimine dahil olan genleri anlamaya yardımcı olması için evrimsel geçmiş ve sinir sistemindeki bazı hastalıklar kullanılacaksa da bu makalenin ana odağı gelişim bakış açısı olacaktır.
Makalenin kalan kısmı beş ana bölüme ayrılacaktır. 2. Bölümde, sinir kök hücrelerinin ilk gelişimi ve çoğalması, yani nöroblast, ayrıntılı olarak ele alınacaktır. Tüm süreci daha iyi anlamak için birçok gen, protein ve yolaklar bazı ayrıntılarıyla irdelenecektir. Daha sonra 3. Bölümde, beyin gibi daha karmaşık doku ve organların oluştururken nöronların nasıl özelleştiği ve kısımlara ayrıldığını daha iyi açıklamak için ileri gelişim evreleri incelenecektir. 4. Bölümde sinir sistemindeki bu farklılaşma ve çoğalmanın nasıl durma noktasına geldiği ele alınacaktır. Bu alanla ilgili bilgiler kısıtlı olduğundan konuyu derinlemesine inceleyen bir bölüm olmayacaktır, bununla birlikte yararlı olacağı düşünüldüğünden alandaki son çalışmaların bazıları eklenmiştir. Evrim, makalenin bütününde konunun ayrılmaz bir parçası olarak işlenecekse de 5. Bölümün ana ilgi odağı, evrimsel bakış açısı olacaktır. Son olarak 6. Bölümde ise, bütünlüğü sağlamak üzere, varılan sonuç kısa bir şekilde anlatılacaktır.
Makaledeki anlatım tarzının akademik bir makale ile popüler bir bilim yazısı karışımı olduğuna lütfen dikkat ediniz. Dersin yazar üzerindeki genel izlenimi bu yönde olduğundan bu yaklaşım bilerek seçilmiştir. Bununla birlikte makalenin büyük kısmı, genel dergi makalesi kurallarına uygundur. Okurun dikkatini kaybetmemek adına bazı açıklamalar ve popüler bilim benzeri parçalar eklenmiştir. Son olarak, Kaliforniya Teknoloji Enstitüsünden evrenbilimci Sean Carroll’ın dediği gibi:
Bilim, hikâye anlatıcılığının karşıtı değildir. Bilim, bir çeşit hikâye anlatımıdır. Gerçek dünyadaki gözlemlerden esinlenilen, gerçek dünyanın hikâyeleri.
Veya büyük taşılbilimci Stephen Jay Gould’un daha kasvetli, ama yine de ilham verici sözleriyle:
Bizler, hikâyeler anlatan hayvanlarız ve günlük hayatımızın sıradanlığını kabullenmeye katlanamayız.
/evrimagaci.org/dosyalar/icerikler/06507357_02-nervoussyste2314m.png)
II. Sinir Kök Hücrelerinin İlk Gelişimi ve Çoğalması: Anahtar Sözcük "Asimetri"!
Beyin gelişiminin en önemli kısmı kesinlikle beyindeki nöronların oluşumu ve özelleşmesidir. Bu bölümde sinek ve insan (veya memeli) beynindeki nöronların gelişimi incelenecektir.
Memelilerdeki nöron gelişiminin ilk kritik noktası, öncül kök hücrelerinin önce “ikincil öncül” denen aracı hücrelere simetrik olarak bölünmesidir. Yakın zamana kadar sinek beyinlerinde bu öncül hücrelerin nasıl üretildiğiyle ilgili olarak memeli hayvanlar ile sinekler arasında benzerlik olup olmadığı bilinmiyordu. Bello ve ark. Drosophila beyninde de aracı öncüller olduğunu gösterdiler [9]. Ceron ve ark. bu bölünmelerin gelişimin evresine de bağlı olduğunu kanıtladılar [10]. İlk larvada nöroblastlar iki ayrı nöroblast oluşturmak için simetrik olarak bölünürler, beyin gelişiminin sonraki evrelerinde ise nöroblastların çoğu asimetrik olarak bölünür. Bu bulgular, sinir hücre çoğalımının kilit noktalarından bir kısmının memeliler ve böceklerde örtüşebileceğini göstermesi açısından önemlidir.
Drosophila’nın sinir kök hücreleri (veya “nöroblast”ları) nöroektodermden ayrılır ve bir dizi asimetrik hücre bölünmesine uğrar [11]. Hatta nöroblastların sayısı bile izlenebilir. Ektodermin nörojenik kısmından katmanlar halinde ayrılan yaklaşık 100 nöroblast olduğu, bunun 25 kadarının da ikincil öncül sinir hücresine dönüştüğü doğrulanmıştır [12], [13]. Bu hücrelerin her biri nöroblastları yeniler, bu arada bir taraftan da bir grup sinir öncül hücresi oluşturur. Bu öncül hücrelere bazen Gangliyon Ana Hücresi (GAH) denir. Bu hücrelerin kaderi, nöroblastlarınkinin tamamen tersidir. Tek bir GAH mitoz bölünmenin yavru hücreleri, hücre döngüsünü devam ettirmez ve farklılaşmaya başlarlar [14]. İlgili bazı anahtar genlerin ismini alan Prospero ve Miranda gibi yolakları kapsayan bu süreç boyunca, nöroblastların sadece bazıları bu aracı hücreleri üretirlerken çoğu nöroblast proliferatif bölünmenin asimetrik moduna döner. Nöroblastlar, böylece yetişkine-özgü ikincil nöronlardan soy hattına ait diğer öbekleri oluşturabilirler. ) Drosophila beyninde farklı nöronların nasıl üretilebildiğinin arkasındaki temel fikir budur [15].
/evrimagaci.org/dosyalar/icerikler/07577948_f2large-2jpg.jpg)
Bu süreçte karşımıza çıkan ilk gen Prospero’dur. Interactive Fly’da açıklandığı üzere [16], Prospero geni şu soruyu cevaplaması açısından ilginçtir: “Embriyolojik gelişim sırasında tek bir hücre bölünmesinin yavru hücreleri nasıl tamamen farklı iki dokudaki farklı iki hücre tipine yol açar?” Bu soruyu cevaplayabilmek kritiktir, çünkü beynin farklı parçalarını oluşturmak amacıyla nöronların birbirlerinden nasıl farklılaştığını açığa çıkarmada belirleyicidir. Bu farklılaşma olmadan, beyin parçaları belli alanlarda özelleşemezdi, dolayısıyla bedenin karmaşık hareketleri ve kontrolü de mümkün olamazdı. Bu büyük soruya verilecek cevap, çok büyük ihtimalle prosepero geni kullanılarak üretilen prospero proteininin doğasında yatıyor. Bu gen proteine dönüştürülürken son ürün hücre içerisine homojen bir şekilde yayılmaz. Daha çok, hücrenin bir ucunda ve genellikle hilal şeklinde toplanır. Bu homojen olmayan toplanma nedeniyle oluşan hücre “kutuplaşması”, hücrede bir olaylar serisi başlatır; Numb geni ürünlerinin üst üste binmiş kutuplaşması, Inscutable geni ürünlerinin zıt kutuplaşması gibi. Hücrede üç proteinin zarla hücre iskeleti arasında kutuplaşması, aktin aktivitesini bozarak hücrenin mikrolifsi ağını etkiler.
Evrim Ağacı'nın çalışmalarına Kreosus, Patreon veya YouTube üzerinden maddi destekte bulunarak hem Türkiye'de bilim anlatıcılığının gelişmesine katkı sağlayabilirsiniz, hem de site ve uygulamamızı reklamsız olarak deneyimleyebilirsiniz. Reklamsız deneyim, sitemizin/uygulamamızın çeşitli kısımlarda gösterilen Google reklamlarını ve destek çağrılarını görmediğiniz, %100 reklamsız ve çok daha temiz bir site deneyimi sunmaktadır.
KreosusKreosus'ta her 50₺'lik destek, 1 aylık reklamsız deneyime karşılık geliyor. Bu sayede, tek seferlik destekçilerimiz de, aylık destekçilerimiz de toplam destekleriyle doğru orantılı bir süre boyunca reklamsız deneyim elde edebiliyorlar.
Kreosus destekçilerimizin reklamsız deneyimi, destek olmaya başladıkları anda devreye girmektedir ve ek bir işleme gerek yoktur.
PatreonPatreon destekçilerimiz, destek miktarından bağımsız olarak, Evrim Ağacı'na destek oldukları süre boyunca reklamsız deneyime erişmeyi sürdürebiliyorlar.
Patreon destekçilerimizin Patreon ile ilişkili e-posta hesapları, Evrim Ağacı'ndaki üyelik e-postaları ile birebir aynı olmalıdır. Patreon destekçilerimizin reklamsız deneyiminin devreye girmesi 24 saat alabilmektedir.
YouTubeYouTube destekçilerimizin hepsi otomatik olarak reklamsız deneyime şimdilik erişemiyorlar ve şu anda, YouTube üzerinden her destek seviyesine reklamsız deneyim ayrıcalığını sunamamaktayız. YouTube Destek Sistemi üzerinde sunulan farklı seviyelerin açıklamalarını okuyarak, hangi ayrıcalıklara erişebileceğinizi öğrenebilirsiniz.
Eğer seçtiğiniz seviye reklamsız deneyim ayrıcalığı sunuyorsa, destek olduktan sonra YouTube tarafından gösterilecek olan bağlantıdaki formu doldurarak reklamsız deneyime erişebilirsiniz. YouTube destekçilerimizin reklamsız deneyiminin devreye girmesi, formu doldurduktan sonra 24-72 saat alabilmektedir.
Diğer PlatformlarBu 3 platform haricinde destek olan destekçilerimize ne yazık ki reklamsız deneyim ayrıcalığını sunamamaktayız. Destekleriniz sayesinde sistemlerimizi geliştirmeyi sürdürüyoruz ve umuyoruz bu ayrıcalıkları zamanla genişletebileceğiz.
Giriş yapmayı unutmayın!Reklamsız deneyim için, maddi desteğiniz ile ilişkilendirilmiş olan Evrim Ağacı hesabınıza üye girişi yapmanız gerekmektedir. Giriş yapmadığınız takdirde reklamları görmeye devam edeceksinizdir.
Hücre farklılaşması süresince birçok farklı gen ve gen ürünleri arasındaki karmaşık ağı anlamak için Miranda hakkında bilgi vermekte fayda vardır. Interactive Fly internet sitesinde açıklandığı üzere, araştırmacılar aslında prospero genini ararken bu yolağı bulmuşlardır [17]. Tıpkı kendisine benzeyen Prospero ve Numb proteinleri gibi, Miranda da mitoz sırasında asimetrik olarak yerleşir ve dolayısıyla GAH hücresine homojen olarak aktarılamaz. Bununla beraber, Prospero ve Miranda arasında temel bir farklılık vardır: GAH daha sonra özelleşmiş hücrelere bölününce, Prospero zardan geçerek çekirdeğe yerleşirken Miranda’nın varlığı tespit edilemez. Bunun neden ve nasıl olduğu açık değildir. Bilinen sadece şudur: Eğer Miranda var olmazsa Prospero, bölgesel olarak kutuplaşamaz ve bu nedenle nöroblastın iki yavrusuna da eşit biçimde dağılır. Sonuç olarak hücre farklılaşması uygun bir şekilde gerçekleşemez. Miranda’ya gelince, Prospero ile birlikte, zarda hilal formlarını oluşturarak kutuplaşmak için yukarıda bahsedilen inscutable genine ihtiyaç duyar. Bu süreç boyunca Miranda, Numb ile etkileşimde bulunur ve kimi zaman Miranda’nın olmayışı Numb’ın kutuplaşamamasına veya yetersiz kutuplaşmasına neden olabilir.
Prospero, Miranda ve Numb kutuplaşmasının ve onların hücre iskeleti üzerindeki etkilerinin sonucu olarak, mitoz bölünmeyle oluşan yavru hücreler bu iki genin protein ürünlerinden farklı miktarlarda alırlar, yani bir hücre bu proteinlerden çokça alırken diğeri neredeyse hiç protein alamaz. Sonrasında da, mitoz hücre bölünmesinin görünürde aynı olan ürünleri hücre farklılaşmasına yol açan temel bir farklılığa sahip olurlar [18]. Açıkça görülüyor ki bu proteinler arasındaki etkileşimi ve hücredeki iğcikleri (ve biçimlerini) anlamak, yolağın tam olarak nasıl işlediğine ışık tutmak için çok önemlidir. Yu ve ark. literatürü inceleyerek Inscuteable ve hücredeki mikrotübüller arasındaki etkileşimi gösteren bazı çalışmaları tespit etmeyi başardılar [19]. Bu çalışmalarda, mikrotübüllerin Inscuteable genine farklı bir bağımlılığı olduğu ele alınıyor, hem yukarıda bahsedilen proteinlerin asimetrik toplanmaları hem de heterotrimerik G gibi bazı başka proteinlerle mikrotübüllerin özellikleri arasında doğrudan bir ilişki olduğu gösteriliyordu.
/evrimagaci.org/dosyalar/icerikler/07644410_135782012article81fi.jpg)
Merkezi ve çevresel sinir sisteminin farklılaşmasında rol alan, Notch gibi başka yardımcı genler de vardır. Portin tarafından açıklandığı üzere, Notch geninin ürünü hücre yüzeyindeki transmembran reseptördür [20]. Bu protein, komşu tanımada anahtar etkenlerden biri olduğu için önemlidir. Ligandları olan Serrate ve Delta’nın yardımlarıyla ve Presenilin proteolitik mekanizma gibi başka mekanizmalarla bazı hücre içi tepkime zincirlerini kontrol ederek proteinleri baskılar ve hücre farklılaşmasını yönlendirir. Ancak tepkime zincirlerinin ayrıntıları bu makalede ele alınmayacaktır. Yine de, Drosophila beyninin embriyo sonrası gelişiminde Notch geninin ne kadar önemli olduğunu anlamak ve daha önce söz edilen Notch ve Numb arasındaki karşılıklı etkileşimi daha ayrıntılı öğrenmek için Lin ve ark.nın çalışmalarına başvurulabilir [21]. Truman ve ark. tarafından açıklandığı üzere, ikincil nöroblast öncüllerde Notch geninin anahtar bir gen olduğunu söylemekte de fayda vardır [22].
Hücre döngüsünün zamanlama ve evrelerinin, nöroblastların farklılaşma ve özelleşmesini etkilediği de bilinmektedir [23]. Geniş ölçüde incelenmiş ve bilinen hücre döngüsü düzenleyicilerinin -cdc2/CDK1, Polo, Aurora A ve cyclin E gibi- rolü, hücre döngüsü ve asimetrik bölünme sistemi arasındaki bağlantıları oluşturmaktır. 2011’de Reichert, mitoz sonrası nöronların ortaya çıkmasını sağlayan nöroblastların, aynı zamanda nöronların hücre döngüsünden çıkma zamanını da etkileyerek hangi hücrenin ne olacağını doğrudan belirlediğini açıklamıştır [24]. Reichert; Hunchback, Kruppel, Pdm ve Castor gibi bazı transkripsiyon faktörleri ve onların salgılanma düzenlerinin, son farklılaştırıcı bölünme ve programlanmış hücre ölümü üzerinde etkileri olduğunu belirtmiştir. Bu başlık 3. Bölümde ayrıntılı olarak işlenecektir. Drosophila beyninde bir yapı oluşturabilmek için nöronların kullandığı iki en yaygın hücre döngüsü çıkış stratejisinin bunlar olduğunu bilmek önemlidir. Nöroblast hücre döngüsü çıkışında hedgehog (Hh) uyarımının kritik olduğu da bilinmektedir: Eğer aşırı bir Hh uyarımı varsa hücreler olgunlaşmadan hücre döngüsünden çıkarlar, eğer uyarım eksikse çıkışta gecikme oluşur ve bu da aşırı hücre çoğalımına neden olur [25]. Bu yolakları incelemek ilginçtir, çünkü insan beynindeki bu sistemle ilgili sorunlar, tümör oluşumuna neden olan aşırı büyümeyle bağlantılıdır [26], [27].
Hücre içi ipuçları nöroblast bölünmesi açısından ilginçtir, çünkü bu uyarılar hücre bölünmesini yönlendireceklerdir. Hücre kutuplaşması için önemli iç işaretlerden biri sentrozomdur. 2007’de Higginbotham ve Gleeson tarafından açıklandığı üzere, sentrozomun pozisyonu nörogenez, göç ve farklılaşma üzerinde vazgeçilemez etkilere sahip olabilir [28]. Sentrozom ayrıca hücre kader faktörlerinin ayrışmasında, nükleokinetiğin yeterli ve verimli olmasında ve yönlendirilmiş nörit büyümesinde görev alır (nörit büyümesi yönü Truman tarafından kapsamlı olarak ele alınmıştır [29]). Örneğin DSas-4 geni mutasyona uğramış olan Drosophila, embriyo gelişimi sırasında sentriyollerini kaybetmeye başlar. Sonuç olarak, larva aşamasındaki nöroblastlarda -ki nöral özelleşmenin temeli olduğu kanıtlanmıştır- asimetrik bölünmelerin yaklaşık %30’unun anormal olduğu gözlenmiştir [30].
Makalenin bu noktasına kadar sözü edilen genler ve yolaklardan bazıları (veya çoğu) arasında ilişki kurma çabaları olmuştur. 2009’da Kim ve ark. mitotik iğcik ve asimetrik protein toplanması arasındaki ilişkiyi Prospero, Aurora-A, atipik protein kinaz C gibi proteinlerin ve beyin tümörünün etkileri üzerinden incelediler. Nöroblast özelleşmesindeki bu iki kritik sürecin, yani mitotik iğcik ve asimetrik protein toplanmasının, hücre döngüsünün gelişim ve büyüme kontrolüyle yakından ilişkili olduğunu kanıtlamayı başardılar. Gelişim kısmı bu makalede ele alındı, daha ayrıntılı olarak da incelenecektir. Büyüme kısmı ise makalenin uzunluğu dikkate alınarak burada yer almayacaktır. Hücre büyümesi ile sinir hücresi farklılaşması arasındaki bağlantıyı kuran (pros geni gibi) genlerle ilgilenen okuyucuların 2005 Prokopenko çalışmasına başvurması önerilir [31].
Her ne kadar bu makale daha çok hücre bölünmesi ve farklılaşmasını yönlendiren iç mekanizmalara yoğunlaşsa da nöroblastın GAH hücrelerine (yavru hücrelere) bölünmesini etkileyen pek çok dış ipucu da vardır. Örneğin daha önce, hücre kutuplaşması sonrasında farklılaşma oluşmasının açıklandığı gibi, birörnek olmayan kutupların farklı yavrulara gidebilmesi için hücrenin hangi eksenden bölüneceğini nasıl “bildiği” sorulabilir. 2006’da Siegrist ve Doe tarafından yürütülen bir çalışmada, epitel hücrelerle temas halinde olan nöroblastların GAH hücre gelişimini hep aynı yönden, epitelyum-nöroblast temas bölgesinin aksi yönünden, başlattığı gösterilmiştir [32]. Bu durum hem canlı görüntüleme hem de in vitro ve in vivo çalışmalarda edinilen verilerle kanıtlanmıştır. İzole nöroblastlar, GAH hücre gelişimini gelişigüzel bir şekilde başlatırlar; bu bilgi, hücre bölünmesini ve daha önce açıklanan asimetri dağılımını yönlendiren kritik dış ipuçları olduğunu kanıtlamaktadır.
/evrimagaci.org/dosyalar/icerikler/07675471_f1largejpg.jpg)
Başka bir çalışmada, Urbach ve ark. nöroblast oluşumunun aynı zamanda vücut bölgelerine göre değiştiğini, ki bu da bir dış ipucu sayılabilir, ilk kez açıkça kanıtlarıyla sunmuşlardır [33]. Araştırmacılar, Drosophila beynindeki prosefalik bölge nöroektoderminin komşu nöroblastlar şeklinde gelişirken gövdede bu bitişikliğe rastlanmadığını göstermişlerdir. Araştırmacılar ayrıca bu çalışmada achaete, scute, lethal of scute ve atonal gibi genlerin prosefalik nöroektoderm özelleşmesiyle ve her bir nöroblastın oluşumuyla ilişkisini de kurmuştur. Ancak literatürde bununla ilgili çelişen bazı bilgiler de vardır. Örneğin Doe, Drosophila’nın göğüs ve karın kısımlarındaki nöroblast desenlenmesini birbirinden ayırt etmenin mümkün olmadığını göstermiştir, bir taraftan da nöroblast veya GAH hücresinin bulunduğu evre ve pozisyonun GAH hücresinin ne zaman ve nerede olduğunun, bazı özel durumlarda farklılaşmayı etkileyebileceğini öne sürmektedir [34].
Buradan anlaşıldığı gibi, ilk sinir hücre bölünmesi, gelişimi ve farklılaşmasını etkileyen pek çok gen ve yolak bulunmaktadır. Açıkça görülüyor ki son birkaç on yıl boyunca, miRNA [35], bazı başka transkripsiyon faktörleri [36], mitotik etki alanı [37], DE-cadherin [38] vs. gibi nöral özelleşmeyi yönlendiren birçok başka iç ve dış ipucu keşfedilmiştir. Bir sonraki bölümde, başka gen ve yolaklardan da bahsedilecektir. Tek bir makalede bütün gen ve yolaklardan bahsetmek mümkün olmadığı için sadece bazıları ayrıntılarıyla incelenecektir.
/evrimagaci.org/dosyalar/icerikler/06774792_03-brai321412ns3png.png)
III. Drosophila Beyninin Özelleşmesi ve Gelişimi
Drosophila ve memeli beyinlerinin nörojenerasyonuna ait bakış açıları açıklayıcı olmasına rağmen sonuçta beynin gelişimi ve bölgelere ayrılışı da heyecan vericidir. Bu bölüm, beynin beynin gelişim basamaklarında nasıl kısımlarına ayrıldığı ve bu süreç içinde nöronların nasıl geliştiği ile ilgili sorulara cevaplar bulmaya çalışacaktır. Bu sorulara cevap vermek, insan beyni gibi son derece karmaşık yapıların nasıl hassas bir şekilde bölgelere ayrıldığını anlayabilmemize olanak sağlayacağından oldukça önemlidir. Bununla birlikte insan beyni ile (hatta primat beyni ile de) çalışmanın zorlukları sinekler gibi daha uzak akrabalarımıza yönelme ihtiyacını doğurmaktadır. Bu genellikle büyük bir sorun değildir, çünkü beyin gelişiminin genetik yolakları taksonlar boyunca oldukça iyi korunmuştur.
Drosophila beyninin kısımlara ayrılması ile ilgili genel bir anlayışa sahip olmak için Lichtneckert ve Reichert’in 2008 yılında yaptıkları çalışma incelenebilir. Bu araştırmacılar, orthodenticle (otd/Otx) ve empty spiracles (Ems/Emx) genlerinin beynin ön bölgesinin belirlenmesinde, homeotik gen ailesinin (Hox genlerinin) arka beynin oluşumunda rol oynadığını ve Pax genlerinin ise bu iki bölge arasındaki sınırı belirlediğini göstermişlerdir [39]. Ayrıca araştırmacılar, beynin bölümlere ayrılmasında rol oynayan moleküler mekanizmaların, evrim tarihindeki beyne sahip her canlıda neredeyse aynı şekilde korunduğunu göstererek konuyu daha ileriye taşıdılar.
Aynı çalışmada, anneden gelen (maternal) genlerin birçok kafa kısmının oluşumunda rol oynadığı gösterilmiştir. Söz konusu Otd ve Ems homeobox genleri, sefalik boşluk genleri adı verilen bir gruba aittirler. Bu genler, tll (tailless), btd (bottonhead) ve slp (sloppy paired) genleri ile birlikte çalışarak kafa segmentini oluştururlar. Deneyler, bu genlerden herhangi birinin işlev kaybı mutasyonuna uğraması halinde bazı kafa segmentlerinin hiç oluşmadığını göstermiştir. Bu genler, sadece beynin kısımlaşmasında, gelişimi yönlendirmekle kalmayıp aynı zamanda nöroblastların ilk gelişimlerinde ve ektodermden farklılaşmasında da rol oynamaktadırlar. Sefalik boşluk genlerindeki mutasyonların erken nöron belirlenmesinde hatalara yol açtığı da gösterilmiştir. Bu genler, korunmuş genetik yapılanma mekanizmalarının yeniden kazanılmasında ve bu makalenin sonraki bölümlerinde incelenecek olan böcek ve omurgalı beyni gelişiminin evrimsel geçmişini ortaya çıkarmada kullanılacak önemli bir araçtır [40].
/evrimagaci.org/public/images/dyn/35fe3f5486340d7c8ec9f7ad5266306d.png)
Beynin bölümlere ayrılmasında rol alan onlarca hatta yüzlerce gen vardır ve bunlardan her biri beynin farklı parçalarında farklı roller üstlenmiş durumdadır. Örneğin; Lab (labial), Pb (proboscipedia), Dfd (deformed), Scr (sex combs reduced), Antp (Antennapedia), Ubx (Ultrabithorax), Abd-A (abdominal-A), Abd-B (abdominal-B) genleri yalnızca Drosophila arka beyninin oluşumunda görevli genlerdir [41], [42]. Bu genlerin çoğu, nöroblast oluşumu ve yapılanmasının konumu ve zamanında (Bu genlerin çoğu, nöroblastların ne zaman ve nerede oluşup yapılanacaklarında) rol oynayacağından sinirsel gelişimdeki etkilerinin anlaşılması önemlidir [43].
Belli genlere odaklanmaktansa, sinirsel gelişimde zamana bağlı nöral kimlik kazanımıyla doğrudan ilişkili olan ardışık gen ifadesi incelenmelidir. Gen ifadesinin ardışık sıralanması bazen “zamanlayıcılar” olarak adlandırılır. Örneğin; Grosskortenhaus ve ark. nöroblast hücre soy hatlarının sinirsel gelişimin ileri basamaklarında nasıl düzenlendiğini anlamak üzere sırasıyla “hunchback”, “Kruppel”, “pdm1” ve “castor” genleri ve bunların ardışık ifadeleri üzerine çalıştılar. Bu zamanlayıcılar yalnız erken gelişimde değil, embriyo sonrası sinirsel gelişimde de aktif durumdadırlar. Dahası Cleary ve Doe’nin 2006 yılında gösterdiği gibi, zamanlayıcılar nöroblastların –özelleşmiş hücrelere farklılaşma- yeterliliğini de düzenlerler. Yani bu zamanlayıcılar, aynı soy hattında, aynı yolak üzerinde, farklı hücre tiplerine farklılaşmayı sağlamak için çoklu yeterlilik aralıkları oluşturabilirler [44]. Sırasıyla hunchback, Pouhomeodomain proteinleri 1-2, castor ve grainyhead gibi zamanlayıcıların, merkezi sinir sistemi soy hattı gelişimi sürecinde, nöroblast gen ifadesinin programlı dönüşümü üzerindeki etkisi Brody ve ark. tarafından incelenmiştir [45].
/evrimagaci.org/dosyalar/icerikler/07715335_nf3eu1q8ewtljnmfn4t0.jpg)
Bu genlerin kromozomlar üzerindeki yerleri ve beyindeki aktiviteleri arasındaki olağandışı bir ilişkiden de bahsedilmelidir.Gen kümelerinin 3’ uçlarına doğru yerleşim gösteren genler, 5’ uçlarında olanlara göre embriyoda daha erken ve daha ön bölgelerde ifade edilmeye eğilimlidir. Bu olgu, genlerin kromozomal yerleşimi ve ifade edilmesindeki zamanlama arasında bir ilişki olabileceğini göstermektedir. Araştırmacılar memeli beyin gelişiminde de spasyal ve temporal korelasyon gelişiminde de benzer bir konum ve zaman ilişkisi (veya eş-doğrusallık) buldular [46], [47].
Drosophila sinir sistemi gelişimiyle ilgili bir diğer ilginç olay, ventral sinir ipliği oluşumudur. Sinekler omurgasızlar sınıfından olduğu için, sinir ipliği oluşumları açısından, insanlar gibi omurgalı memelilerle benzerlik göstermedikleri düşünülebilir. Bu yanlış bir varsayım olur, çünkü hem memeliler hem de sineklerdeki sinir ipliği oluşumunda görev alan genlerin homolog oldukları gösterilmiştir. Daha da ilginci, Skeath ve ark. maternal anterior-posterior koordinatların nöroblastların sıralanmaları konusunda önemli bir rol oynadıklarını gösterdiler [48]. Araştırmacılar daha sonra, sinir ipliğinin her bir alt kısmını tanımlamada çok temel ve bir o kadar da muhteşem boşluk ve çift kurallarını uyguladılar. Bu süreç boyunca vnd, ind ve msh gibi genler, nöral ipliğin dorsal-ventral segmentasyonunda önemli rol oynar. Nöroblast farklılaşmasının birincil ve ikincil soy hatlarıyla ilişkili ventral sinir ipliğinin bazı ilginç detayları Birkholz ve ark.'nın 2015’teki çalışmasıyla gün yüzüne çıktı [49]. Araştırmacılar, ventral sinir ipliğinin anterior-posterior ekseni boyunca özellikle ikincil embriyonik nöroblast alt-soy hatlarının reaktivasyon özelliklerinin anlaşılmasını sağladılar. Bu daha önce teknik yetersizliklerden dolayı yapılamamıştı. Bu çalışma, araştırmacıların erken larva embriyonik gelişim sürecini embriyo sonrası gelişim süreciyle ilişkilendirebilmelerine yardımcı olduğundan önemlidir.
Elbette Drosophila sinir sistemi gelişimiyle ilgili çok daha fazla söylenecek şey vardır. Burada güncel çalışmaların bazıları biraraya getirilerek sunulmaya çalışıldı. Bu başlıkların her biri, literatürdeki yüzlerce makale ile çok daha fazla alt başlıklara ayrılabilir. Burada sunulan araştırma okuyuculara yeterli bir başlangıç olacağı düşünülerek hazırlanmıştır.
/evrimagaci.org/dosyalar/icerikler/07076976_fig2-or3214123gans1p.png)
IV. Embriyo Sonrası Gelişimde Hücre Çoğalımının Sonlanması
Çok sevilen Taht Oyunları (Game of Thrones) dizisinin sloganı şöyledir: “Hiç kimse ölümden kaçamaz.” Benzer şekilde, tüm embriyo gelişimi de bir noktada durmak zorundadır. Pekiyi, hücreler ne zaman duracaklarını nasıl biliyorlar? Neden sonsuza kadar bölünmeye devam etmiyorlar? Bu bölümde, bu sorulara cevap aranacaktır.
Drosophila beyin gelişimindeki önemli homeobox genlerden birinin labial geni olduğu bilinmektedir ve bu makalede de yüzeysel olarak bu genden bahsedilmiştir. , Labial gen ifadesi çoğunlukla sinek beyninin tritoserebrumunda gerçekleşir, eğer bu gen işlev kaybı mutasyonuna uğrarsa bölgedeki nöronlar kimliklerini kaybederler. Diğer bir deyişle, nöronlar düzgün bir şekilde farklılaşamaz veya işlevlerini yerine getiremezler. Bu tür mutasyonlar beyin gelişimi sırasında oluşursa ciddi yapılanma kusurları da gözlenir [50]. Fakat bu makalede daha önce derinlemesine incelendiği gibi, bu tür aktivite başarısızlıklarının oluş zamanı birbirinden tamamen farklı sonuçlar doğurabilir. Aslında gen deaktivasyonu için durum tam da budur.
Kuert ve ark. tarafından yapılan bir çalışmada araştırmacılar, labial gen ifadesinin altı larva beyin nöroblastında gerçekleştiğini, fakat bunlardan sadece dördünün son larva beyninde hâlâ bu işleme devam edip nöroblast soy hatları oluşturduğunu göstermişlerdir [51]. Eğer labial geni işlevini kaybetmemişse diğer ikisi ektopik nöroblast soy hattı oluşturur. Bu demek oluyor ki hücre çoğalımının programlı hücre ölümü yoluyla düzgün sonlanması isteniyorsa bu iki nöroblast soy hattında labial geni olmak zorundadır.
Hücre çoğalımının sonlanmasından söz ederken bir başka ilginç gen/proteinden de bahsedilmelidir: Scribble. Hem daha önce bahsedilen sinir hücresi farklılaşmasındaki nöroblast kutuplaşması hem de epitel kutuplaşmada rol oynayan Scribble, Drosophila’da tümör baskılayıcı bir proteindir. Scribble LRR, PDZ ve CT denen 3 bölgeciğe sahiptir. Albertson ve ark. LRR ve PDZ2 bölgeciklerinin mitotik nöroblastlardaki kortikal ve apikal yerleşimlerde görev aldıklarını bulmuşlardır [52].
Hücrelerin yeterince mucizeler yaratıp artık durmaları gerektiğine nasıl karar verdiklerini açıklamak için araştırmacılar, Ana, 20E ve, her zaman yapıldığı üzere, beslenme durumu gibi dış faktörler üzerinde yoğunlaştılar, fakat yeterli bir ilişki bulmada başarısız oldular [53], [54]. Hâlâ bu mekanizma hakkında birçok şey bilinmiyor. Bununla birlikte Maurange ve Gould, bu sonlanmanın coiled coil protein Mantar yapı kusuru nedeniyle olduğunu ileri sürmüşlerdir [55]. Bu protein larvada olması gerekenden daha az aktifse sinir hücrelerinin aşırı üretimi nedeniyle birçok merkezi sinir sistemi bölgesi kusurlu bir şekilde gelişir. Ayrıca nöroblast bölünmesinin doğru zamanda durmasını AbdA denen bir homeobox proteini sağlıyor gibi görünmektedir [56].
Çoğalımın sonlanmasıyla ilgili ilginç bir soru da bölgesel sınırlar açısından sorulabilir: “Yeni oluşmuş bu hücreler nerede durmaları gerektiğini nasıl biliyorlar?” Yine, gen ve gen ürünleri arasındaki etkileşim şaşırtıcı sonuçlar sağlayabilir. Örneğin, eğer gooseberry ve vnd gibi gen aktivite bölgecikleri kesişirse bir nöron grubunun sınırı belirlenir. Bir başka gelişim bölgesinde wingless ve ind aktivitesi örtüşmeye başlarsa başka bir sinir grubu sınırları çizilir.
Çoğalımın sonlanması veya sinirsel gelişimle sorun giderilmesinde önemli bir konu da Programlı Hücre Ölümüdür (PHÖ). Bu makalede, gelişimin bu temel ve çok önemli sürecinin tüm ayrıntılarına girilmeyecektir; ancak yine de bütünlüğü sağlamak adına en azından bazı temel bilgiler verilmelidir. Aslında PHÖ, kemik morfogenetik faktörleri gibi daha önce bahsedilen bazı mekanizma aktivitelerinin yanı sıra fibroblast büyüme faktörleri, Wnts ve Sonic Hedgehog gibi daha az bahsedilen aktivitelerle de yakından ilişkilidir. Bütün bu aktiviteler, hem ilk sinir gelişimi hem de PHÖ’nün düzenlenmesinde yer alırlar. PHÖ çoğunlukla hücre sayısının kontrolü, hasarlı veya (konum ya da zaman bakımından) yanlış belirlenmiş hücrelerin yok edilmesi ve hücre seçiliminde görev alır [57].
Daha önce de bahsedildiği gibi, sinir hücresi farklılaşmasının sonlanmasındaki ayrıntılar çok az çalışılmış bir alandır. Yine de, bu bölümde yeterince aydınlatıcı bilgi verilmeye çalışılmıştır; okur, bu noktadan yola çıkarak, hücre farklılaşmasının neden ve nasıl durduğu hakkında, "içindeki Alis’i" takip edebilir (Çvr: burada "Alis Harikalar Diyarında" isimli esere atıfta bulunulmuştur).
/evrimagaci.org/dosyalar/icerikler/07313969_drosophilac321412312.png)
V. Evrimin Işığında Gelişimi Anlamak
Özellikle sineklerdeki ve insanlardaki beyin gelişiminin bütün farklı yönlerini ele aldıktan sonra, beyin gelişimi ve evriminin detayları bakımından tür içi ve türler arası karşılıklı ilişki hakkında devasa bir veri yığını olduğu anlaşılabilir. Ancak şu soru yine de dağ gibi karşımızda duruyor: “Karmaşık beyin evriminin birleşik bir kuramını oluşturmak için tüm bu noktaları birbirine bağlamak mümkün müdür?”
Gelişimin genetik ve biyokimyasal yolaklarına dair temel prensipler göze çarpan şekilde benzerlik taşısalar da beyin yapısının memelilerde, diğer soy hatlarındakilere kıyasla, çok daha dinamik olduğu kabul edilmelidir. Bunun sonucunda, davranış varyasyonlarındaki (çeşitliliğindeki) karmaşıklık memelilerde fazlasıyla değişkendir. Özellikle, primatlar (ve elbette insanlar) gibi daha karmaşık beyin yapısına sahip hayli sosyal memelilerde, bu sofistike davranışların etkileri çok daha barizdir.
Diğer taraftan, çok çeşitli taksonlar içerisinde beyin gelişiminin temelleri ortak olduğu sürece, yukarıda sayılanların hiç biri beyin gelişimine dair birleşik bir kuram inşa etmenin önündeki engeller olmayabilir. Araştırmacılar, fizik kurallarının evrime ve gelişime getirdiği kısıtlamalara dayanarak, beynin kortikal organizasyonunun (kabuksal düzeninin) oldukça korunaklı özellikleri üzerine odaklanıyorlar [58]. 2008 yılında yapılmış bir çalışmada araştırmacılar, sinirsel gelişimin büyük olasılıkla, (süngerler, placozoalar ve taraklılar hariç) hemen hemen tüm hayvanları kapsayan çift yanlı simetrik hayvanların (bilateria) en azından son ortak atasında evrimleşmiş olduğu sonucuna varabildiler [59]. Bu sonucu elde etmek için, hayvanlardaki sinir sisteminin merkezileşme derecesinden (noktasından?) ve sinirsel gelişim bakımından gelişimdeki karmaşık benzerliklerden elde edilen verileri kullandılar.
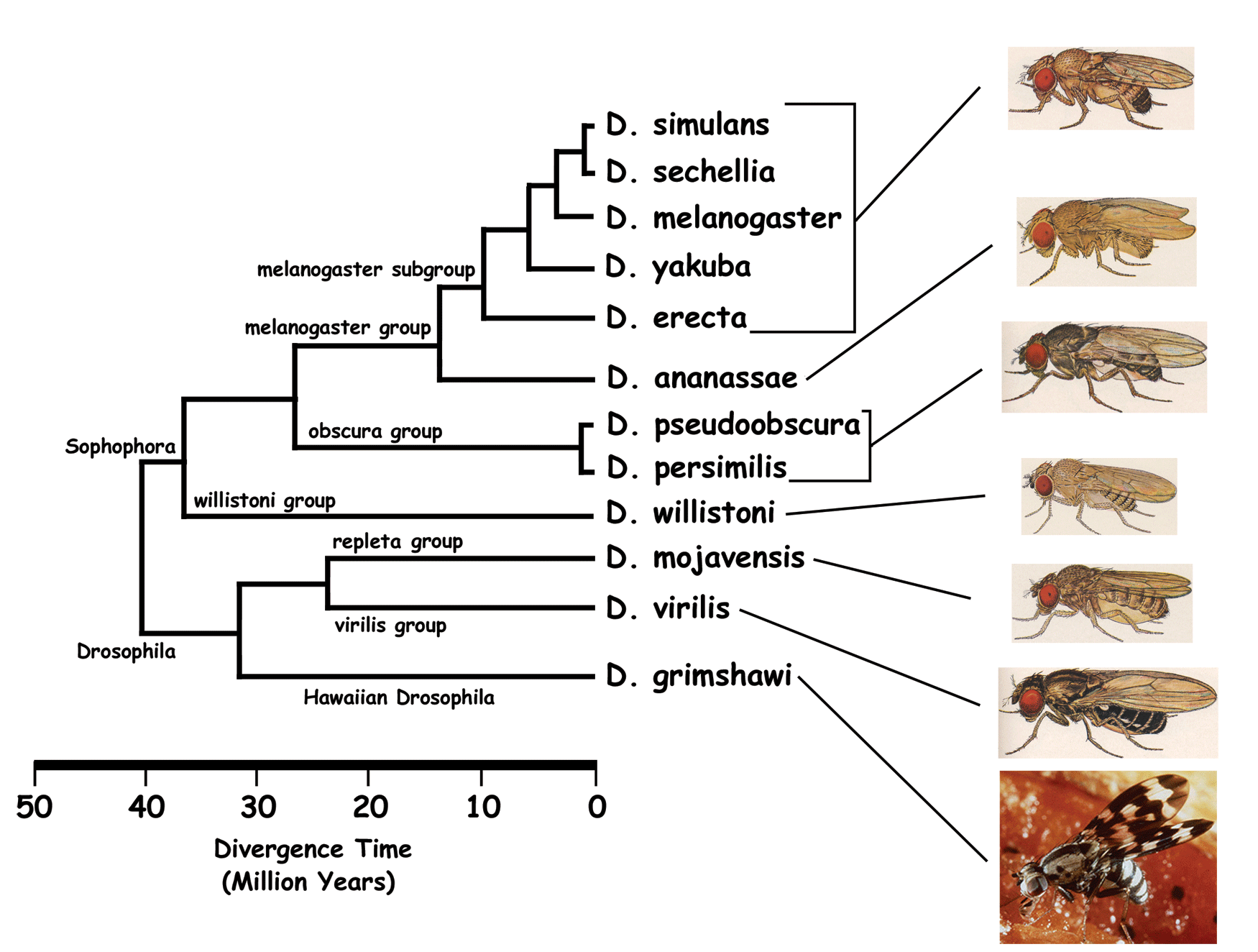
Daha önce bu makalede bahsedilen ventral sinir ipliği, hem omurgalılarda hem de omurgasızlarda ortak bir makro yapı olduğu için evrimsel gelişim biyolojisinin ilgi odağı olmuştur. Harzsch, eklembacaklı kabuklular, altı bacaklılar ve eklem bacaklılar arasındaki benzerlikleri göstermek amacıyla ilave deneyler yaptı ve ventral sinir ipliğinin sinirsel gelişimini ele aldı [60]. Ventral sinir ipliğinin kendine özgü sinirsel belirlenimlerini dikkatlice araştırdıktan sonra Stollewerk ve Simpson, eklem bacaklılardaki evrimsel yönelimin, hücre sayısını azaltarak embriyogenez hızını artırma yönünde olduğunu ileri sürdüler. Nöroblast soy hatlarından karakteristik örnekleriyle kanıtlar sundular.
Gerçekten de evrimsel bakış açısıyla Drosophila beyni ile insan beyni arasındaki homoloji (benzeşiklik) gösterildi [62]. Gelişimsel ve genetik verilere dayanarak Reichert ve ark. ile Hirth, Drosophila’nın protoserebrum, dutoserebrum ve tritoserebrum bölümlerinin omurgalılarda, sırasıyla ön beyin, orta beyin ve arka beyin bölümleriyle homolog (analog değil!) olduğunu ileri sürdüler [63], [64]. Bu yazının önceki bölümlerinde bahsedilmiş olduğu gibi, kısımlaşmadan sorumlu benzer genler ve onların ürünlerinin varlığı bir kez daha karşımıza çıkmaktadır. Örneğin, Inoue ve ark.nın göstermiş olduğu üzere, Otx2 ve Gbx2 gibi genler omurgalılarda orta beyin ve arka beyin arasındaki, sineklerde ise dutoserebrum ve tritoserebrum arasındaki sınırı belirliyor [65]. Dahası, basit rol değişimleri evrimci gelişimsel değişimler hakkında ilginç bilgiler verebilir. Örneğin, Püschel ve ark.nın 1992’de gösterdiği gibi, Pax2/5/8 geni Drosophila melanogaster’in posterior dutoserebrum bölgesinde oldukça fazla transkribe edilmiş bir gen iken, aynı gen orta beyin-arka beyin sınırında da fazlasıyla transkribedir [66].
Sinek sinir kök hücreleri ve memeli sinir kök hücreleri arasındaki benzerlikler yolak kısımlaşmalarıyla veya yolaklarının uyumuyla sınırlı değildir. Örneğin, her iki grubun da kök hücreleri kendilerini yenileyebilirler. Bu yenileme, (hücrenin kendisinin birebir kopyasını yarattığı) simetrik hücre bölünmesi esnasında veya (bir sinir kök hücresi ile çoğalmak için tam bir potansiyele sahip olmayan bir başka hücre oluşturan) asimetrik hücre bölünmesi esnasında olabilir. Bu asimetri makale içerisinde zaten ele alındı, fakat bu örnek konunun daha iyi anlaşılması için verilmiştir. Ayrıca, gerek memeli gerekse de sinek sinir kök hücreleri sadece farklı tür sinir hücrelerine dönüşmekle kalmaz; aynı şeyi gliyal hücreler için de yapabilirler. Sonuncusu ama en önemlisi, bu sinir kök hücrelerinin her ikisi de zaman kaderini zamana bağlı bir tarzda yaparlar (“zamana bağlı hücre kaderi düzenlenmesi” olarak da bilinir.)
Sinir gelişimi benzerlikleri ile ilgili olarak, özellikle hem omurgalılardaki hem de omurgasızlardaki kendini yenileme, çokyetililik (multipotency) ve hücre kaderi belirlenmesi bakımlarından, zengin bir bilgi hazinesi bilime kazandırılmıştır [67]. Son birkaç on yıl boyunca üzerinde çokça çalışılan bir alanı ele almayı gerektirdiği için tüm bu farklı süreçlerin tam ayrıntılarına girmek bu yazının amacı dışına çıkmak olacaktır. Diğer taraftan, Egger ve ark.nın belirttiği üzere [68], tüm bu araştırmaların en kritik tarafı kök hücre araştırmalarından edinilen bulguları bu kök hücrelerin son aşamadaki ürünleriyle (yani özelleşmiş hücreler ile) birleştirmektir. Bu yeni oluşmuş, özelleşmiş hücreler beyindeki bölgelerine nasıl göç eder? Kendilerini yenilemeye nasıl devam ederler? Larval nöronlar yetişkin sinir sistemi hücrelerine nasıl dönüşür? Yine de Drosophila sinir sistemi gelişimi ve onun insan beyni gelişimi ile olan benzerliklerinin büyüleyici bir resmini çizmek için tüm ayrıntılar gerekmeyebilir.
Bu soruların sonuncusuna verilebilecek ilginç bir yanıt, nöroblastların gerektiğinde etkisiz hale getirilebileceği ya da yeniden harekete geçirilebileceği gerçeğinde yatmaktadır. Bu esneklik elzemdir, çünkü bu süreçteki hataların nörolojik zedelenmelere ve nörodejeneratif hastalıklara sebebiyet verebileceği gösterilmiştir. Bu demektir ki sineklerin beyinlerini inceleyerek Huntington [69], Parkinson [70] ve benzeri daha birçok hastalık [71], [72] dahil, insanlık tarihindeki en korkutucu rahatsızlıkların bazılarıyla mücadele edebiliriz. Egger ve ark. örneğin, mitotik olarak aktif olmayan nöroblast pasifliğinden itibaren yetişkin sinir gelişimindeki reaktivasyona ve çoğalmaya kadarki basamakları anlamanın ve onları manipüle edebilmenin nörolojik zedelenmelerin ve hastalıkların tedavisi üzerine muazzam etkileri olacağını ileri sürdüler [68].
Özellikle, sinekler için daha fazla sayıda açıklayıcı genetik tarama yöntemi geliştirilebilirse, bu yöntemler, her iki türe ait sinir gelişimi benzerlikleri sebebiyle, insan nörodejeneratif hastalıklarıyla ilgili gen keşiflerini de destekleyecektir [73].
Yukarıda anılan gen ürünlerinin asimetrik dağılımına ilaveten, nöroblastlar sinir çeşitliliğini başlatmak için üretim yerlerini kullanırlar. Bu, nöroblastların katmanlara ayrılarak çoğaldığı yer olan nöroektoderm üzerindeki konumlarına bağlı olarak ayrılabildiği anlamına gelir. Hayvanlar Âlemi genelinde sıklıkla görülen bir grup gen bu işlemde rol aldığı için bunun ardında yatan genetik mekanizma keşfedilmeye değerdir. Msh/Msx adındaki bir grup homeobox geni gelişmekte olan ektodermin özellikle dorsal (sırt) kısmında aktif hale gelir. Beyin oluşumu sırasında, gelişimin gerçekleştiğin yön (veya doğrultu) (dorsal-ventral, anterior-posterior) bilhassa önemlidir ve bu süreç bu yazıda bahsedilen birçok mekanizma aracılığıyla sağlanabilir. Bu da gelecek bölümlerde ele alınacaktır. Ancak çarpıcı bir keşif 1997’de Isshiki ve ark. tarafından yapılmıştır. Araştırmacılar, Msh/Msx genlerinde basit bir işlev kaybı mutasyonunun dorsal-ventral kader dönüşümünden (fate switch) sorumlu olabileceğini buldular [74]. Ekip, Msh/Msx genleri ve mutasyonların etkileri üzerine çalışırken bu genlerin sinek ve omurgalı genomunda çok önemli ve yaygın bir şekilde korunmuş olduğunu kanıtlamayı başardı.
/evrimagaci.org/dosyalar/icerikler/07822337_spotted-flies-circle.jpg)
Schlosser ve ark.nın yaptığı diğer bir çalışmada, çarpıcı bir genetik yolak benzerliği, sadece sinekler ve memeliler arasında değil, aynı zamanda çift yanlı simetrik hayvanların neredeyse tamamına yakınında bulundu: ektodermi tekrar bölen bir yolak [75]. Kemik morfogenetik proteinleri (KMPler) büyüme faktörü grubu olarak bilinirler. Bazı kaynaklar onlara sitokinler ve metabolojenler olarak atıf yaparlar. Önemleri, kemik ve kıkırdak oluşumunda oynadıkları büyük rolden ileri gelir. Fakat daha ileriki çalışmalar, çeşitli takson kısımları boyunca doku mimarisini yönetmek amacıyla bunların önemli bir morfogenetik uyarı olarak da kullanılabileceklerini gösterdi. Schlosser ve ark. KMP geçişinin ektodermin nasıl bölündüğüyle ve dolayısıyla gelişim sınırlarının nasıl belirlendiğiyle ilgili son derece önemli sonuçlarının olduğunu ortaya koydular.
Bu makalede, Drosophila beynindeki nöroblast farklılaşmasında sentrozomların (ve sentriyollerin) rolü ele alındı. Bu mekanizma, memeli beynindeki mekanizmaya çok benzer olup memeli beyninde de çoğunlukla korunmuştur. Bond ve ark. bir çalışmalarında, iki genin (CDK5RAP2 ve CENPJ) doğum öncesi nörogenez esnasında genlerin nöroepitelyal ifadesini etkilediğini göstermişlerdir [76]. Bu genlerin mutantları, mitotik hücre iğcik kutuplarının yerleşiminde sorun oluştururlar ve bundan dolayı memeli beyninde hatalı farklılaşma meydana gelir.
Hücre polarizasyonunun nöroblast özelleşmesinde önemli bir etmen olduğu açıkça anlaşılıyor. En son şöyle bir soru sorulabilir: “Bu polarizasyonun izini evrim tarihinde geriye doğru ne kadar sürebiliriz?” Çünkü hücre polarizasyonunun ne zaman evrimleşmeye başladığını öğrenebilirsek, bunun açılımlarını çok çeşitli taksonlar içerisinde anlayabiliriz. 2008’de Macara ve ark. bu soruyu cevaplandırmaya çalışmışlar ve bu tür polarizasyonun başlangıcının mayalara, hatta bakterilere kadar uzanabileceğini bulmuşlardır [77]. Ancak bu polarizasyonun amacı, günümüzde nöroblast özelleşmesinde gördüğümüzdekinden biraz farklı gibi durmaktadır. Araştırmacılar, bu evrimsel adaptasyonun başlangıçtaki evriminin, bölünme sırasında yavru hücrenin aşırı olgunlaşmasını sınırlama görevini üstlendiğini belirtmektedirler. Bu, hasarlı materyalin ayırıcı ayrımlaşması sağlanırken meydana gelir. Daha karmaşık organizmalar incelendiğinde, bu organizmaların, değişik sentrozom, RNA, protein ve çeper kalıtımlarını sağlamak için birebir aynı işlevi kullandıkları görülebilir. Bu tür farklılık yaratan kalıtımların nöroblast farklılaşması üzerine olan etkileri bu makalede ele alınmıştı.
/evrimagaci.org/dosyalar/icerikler/07403783_drosophilamelanogast.jpg)
VI. Sonuç
Bu makalede Drosophila beyninin sinirsel gelişimi, başlangıç gelişimi, ileri gelişimi (embriyo sonrası gelişim) ve gelişim sonlanması gibi ana fazlara ayrılarak biraz detaylı bir şekilde incelendi. Daha sonra, sinir sistemi gelişiminden elde edilen bilgilere dayanılarak, dersin evrimsel gelişim yönünün hakkını vermek adına evrimsel biyoloji alanında bazı sonuçlara varılmaya çalışıldı.
Bu makale tüm bu araştırmaların yöntemsel detaylarına girmese de en azından bu tür çalışmalarda kullanılan genel metottan bahsetmekte yarar vardır. İmmünohistokimyasal boyama yöntemi, özellikle Drosophila beyni üzerine çalışılırken, gen düzenlenmesini, hücre tipi belirlenmesini, nöron ve gliyal farklılaşmasını ve dönüşüm sonrası protein modifikasyonunu incelemek için kullanılmıştır [78]. Drosophila beyninin gelişim detaylarını ortaya çıkarmada kullanılan bir diğer yöntem, tritiye timidin uygulamak ve sonra bu kimyasalı otoradyografi kullanarak belirlemektir. Bu metot, özellikle embriyon embriyo sonrası aşamalarda, sinir sisteminin oluşumu esnasında daha önceden açıklığa kavuşturulmuş karakteristik yapıları ortaya çıkarmada araştırmacılara yardımcı olmuştur [79]. Bazı araştırmalarda Golgi-emprenye usulü Drosophila beynini hücresel düzeyde incelemede kullanılırken [80], diğer bazı araştırmalarda ise 5-bromo-2'- deoksiüridin (BrdU), beynin embriyo sonrası nöroblastlarının konum ve zamana bağlı çoğalma yapılanmasını ortaya çıkarmak amacıyla Drosophila DNA’sını etiketlemede (işaretlemede) kullanılır [81]. Bu araştırma sayesinde, embriyo sonrası gelişim süresince her bir beyin yarımküresi için yaklaşık nöroblast sayısı bulunmuştur.
Ayrıca, sinek sinir sistemi çalışmaları için alet ve veritabanı bakımlarından devasa bir bilgi deposu oluşmuştur. Drosophila sinir sistemi araştırmalarında kullanılabilecek çok kapsamlı bir alet takımı Pfeiffer ve ark.nda bulunabilir [82], [83]. Aynı zamanda, Venken ve ark. da ilgili araştırmalarda kullanılabilecek pek çok farklı yöntem ve aleti gözden geçirmişlerdir [84].
Drosophila sinir sisteminin Homo türü de dahil memeli sinir sistemini incelemede faydalı bir model olduğu ortadadır. Birkaç on sayfalık bir makalede yüzeysel düzeyden öte ele alınamayan bir konu olan insanın sinir gelişimi hakkında bu kadar fazla şeyi sadece sinek sinir sistemine bakarak öğrenebilmek oldukça şaşırtıcıdır. Yine de bu makalede tartışılan her bir konu başlığı sineklerin ve insanların sanılandan daha fazla şeyi paylaştığını kanıtlamaktadır. Bunun içindir ki ilk bakışta önemsiz gibi gelen ayrıntılar bile derinlemesine incelenmeyi hak etmektedir. Bu makalede bahsedilen birkaç olguda gösterildiği gibi, önemsiz gibi gözüken bu ayrıntılar insan türü hakkındaki anlayışımızı değiştirebilecek bilgileri gün yüzüne çıkarabilir.
Son olarak, şu sonuca varmaktan başka bir seçeneğimiz yoktur:
Evrimin ışığı olmaksızın biyolojide hiçbir şeyin anlamı yoktur.
Not: Bu makalenin orijinali, İngilizce olarak Texas Tech Üniversitesi BIOL 6100 Advanced Topics In Biology: Evo-Devo (Biyolojide Üst Düzey Konular - Evrimsel Gelişim Biyolojisi) dersi dönem projesi olarak yazılmış ve sunulmuştur.
Kaynaklar ve İleri Okuma
- I. Flatow, "Decoding 'the Most Complex Object in the Universe'," ed: NPR, 2013.
- F. A. Azevedo, L. R. Carvalho, L. T. Grinberg, J. M. Farfel, R. E. Ferretti, R. E. Leite, et al., "Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain," J Comp Neurol, vol. 513, pp. 532-41, Apr 10 2009.
- C. Neupert, R. Schneider, O. Klatt, C. Reissner, D. Repetto, B. Biermann, et al., "Regulated Dynamic Trafficking of Neurexins Inside and Outside of Synaptic Terminals," J Neurosci, vol. 35, pp. 13629-47, Oct 7 2015.
- J. Ortega-Hernández, "Homology of Head Sclerites in Burgess Shale Euarthropods," Current Biology, vol. 25, pp. 1625-1631, 6/15/ 2015.
- L. McGurk, A. Berson, and N. M. Bonini, "Drosophila as an In Vivo Model for Human Neurodegenerative Disease," Genetics, vol. 201, pp. 377-402, Oct 2015.
- C. C. Homem and J. A. Knoblich, "Drosophila neuroblasts: a model for stem cell biology," Development, vol. 139, pp. 4297-4310, 2012.
- V. Hartenstein and J. A. Campos-Ortega, "Early neurogenesis in wild-type Drosophila melanogaster," Wilhelm Roux's Archives of Developmental Biology, vol. 193, pp. 308-325, 1984.
- E. V. Koonin, "Archaeal ancestors of eukaryotes: not so elusive any more," BMC Biol, vol. 13, p. 84, 2015.
- B. C. Bello, N. Izergina, E. Caussinus, and H. Reichert, "Amplification of neural stem cell proliferation by intermediate progenitor cells in Drosophila brain development," Neural Dev, vol. 3, p. 5, 2008.
- J. Ceron, C. González, and F. J. Tejedor, "Patterns of Cell Division and Expression of Asymmetric Cell Fate Determinants in Postembryonic Neuroblast Lineages of Drosophila," Developmental Biology, vol. 230, pp. 125-138, 2/15/ 2001.
- Y.-N. Jan and L. Y. Jan, "Asymmetric cell division in the Drosophila nrevous system," Nat Rev Neurosci, vol. 2, pp. 772-779, 11//print 2001.
- R. Urbach and G. M. Technau, "Molecular markers for identified neuroblasts in the developing brain of Drosophila," Development, vol. 130, pp. 3621-3637, 2003.
- W. Pereanu and V. Hartenstein, "Neural lineages of the Drosophila brain: a three-dimensional digital atlas of the pattern of lineage location and projection at the late larval stage," The Journal of neuroscience, vol. 26, pp. 5534-5553, 2006.
- J A Campos-Ortega and Y. N. Jan, "Genetic and Molecular Bases of Neurogenesis in Drosophila Melanogaster," Annual Review of Neuroscience, vol. 14, pp. 399-420, 1991.
- S. Lin and T. Lee, "Generating neuronal diversity in the Drosophila central nervous system," Developmental Dynamics, vol. 241, pp. 57-68, 2012.
- T. Brody. (1996). prospero Available: ftp://ftp.embl.de/ftp.ebi.ac.uk/pub/delete_databases/flybase/allied-data/interactive-fly/neural/prospero.htm
- T. Brody. (1996). miranda. Available: http://www.sdbonline.org/sites/fly/neural/mirnda1.htm
- J. Betschinger and J. A. Knoblich, "Dare to be different: Asymmetric cell division in Drosophila, C. elegans and vertebrates," Current Biology, vol. 14, pp. R674-R685, 2004.
- F. Yu, C. T. Kuo, and Y. N. Jan, "Drosophila neuroblast asymmetric cell division: recent advances and implications for stem cell biology," Neuron, vol. 51, pp. 13-20, Jul 6 2006.
- P. Portin, "General outlines of the molecular genetics of the Notch signalling pathway in Drosophila melanogaster: a review," Hereditas, vol. 136, pp. 89-96, 2002.
- S. Lin, S. L. Lai, H. H. Yu, T. Chihara, L. Luo, and T. Lee, "Lineage-specific effects of Notch/Numb signaling in post-embryonic development of the Drosophila brain," Development, vol. 137, pp. 43-51, 2010.
- J. W. Truman, W. Moats, J. Altman, E. C. Marin, and D. W. Williams, "Role of Notch signaling in establishing the hemilineages of secondary neurons in Drosophila melanogaster," Development, vol. 137, pp. 53-61, 2010.
- V. Hartenstein, E. Rudloff, and J. A. Campos -Ortega, "The pattern of proliferation of the neuroblasts in the wild-type embryo of Drosophila melanogaster," Roux's Archives of Developmental Biology, vol. 196, pp. 473-485, 1987.
- H. Reichert, "Drosophila neural stem cells: cell cycle control of self-renewal, differentiation, and termination in brain development," in Cell Cycle in Development, ed: Springer, 2011, pp. 529-546.
- P. C. Chai, Z. Liu, W. Chia, and Y. Cai, "Hedgehog signaling acts with the temporal cascade to promote neuroblast cell cycle exit," PLoS Biol, vol. 11, p. e1001494, 2013.
- P. B. Dirks, "Brain tumour stem cells: the undercurrents of human brain cancer and their relationship to neural stem cells," Philos Trans R Soc Lond B Biol Sci, vol. 363, pp. 139-52, Jan 12 2008.
- N. Saini and H. Reichert, "Neural stem cells in Drosophila: molecular genetic mechanisms underlying normal neural proliferation and abnormal brain tumor formation," Stem Cells Int, vol. 2012, p. 486169, 2012.
- H. R. Higginbotham and J. G. Gleeson, "The centrosome in neuronal development," Trends in neurosciences, vol. 30, pp. 276-283, 2007.
- J. W. Truman, H. Schuppe, D. Shepherd, and D. W. Williams, "Developmental architecture of adult-specific lineages in the ventral CNS of Drosophila," Development, vol. 131, pp. 5167-5184, 2004.
- R. Basto, J. Lau, T. Vinogradova, A. Gardiol, C. G. Woods, A. Khodjakov, et al., "Flies without Centrioles," Cell, vol. 125, pp. 1375-1386, 6/30/ 2006.
- S. N. Prokopenko and W. Chia, "When timing is everything: role of cell cycle regulation in asymmetric division," Semin Cell Dev Biol, vol. 16, pp. 423-37, Jun 2005.
- S. E. Siegrist and C. Q. Doe, "Extrinsic cues orient the cell division axis in Drosophila embryonic neuroblasts," Development, vol. 133, pp. 529-536, 2006.
- R. Urbach, R. Schnabel, and G. M. Technau, "The pattern of neuroblast formation, mitotic domains and proneural gene expression during early brain development in Drosophila," Development, vol. 130, pp. 3589-606, Aug 2003.
- C. Q. Doe, "Molecular markers for identified neuroblasts and ganglion mother cells in the Drosophila central nervous system," Development, vol. 116, pp. 855-863, 1992.
- Y. Yuva-Aydemir, X. L. Xu, O. Aydemir, E. Gascon, S. Sayin, W. Zhou, et al., "Downregulation of the Host Gene jigr1 by miR-92 Is Essential for Neuroblast Self-Renewal in Drosophila," PLoS Genet, vol. 11, p. e1005264, May 2015.
- H. Lacin, Y. Zhu, B. A. Wilson, and J. B. Skeath, "Transcription factor expression uniquely identifies most postembryonic neuronal lineages in the Drosophila thoracic central nervous system," Development, vol. 141, pp. 1011-21, Mar 2014.
- V. E. Foe, "Mitotic domains reveal early commitment of cells in Drosophila embryos," Development, vol. 107, pp. 1-22, 1989.
- F. Wang, K. Dumstrei, T. Haag, and V. Hartenstein, "The role of DE-cadherin during cellularization, germ layer formation and early neurogenesis in the Drosophila embryo," Developmental Biology, vol. 270, pp. 350-363, 2004.
- R. Lichtneckert and H. Reichert, "Anteroposterior regionalization of the brain: Genetic and comparative aspects," in Advances in Experimental Medicine and Biology vol. 628, ed, 2008, pp. 32-41.
- R. Lichtneckert and H. Reichert, "Insights into the urbilaterian brain: conserved genetic patterning mechanisms in insect and vertebrate brain development," Heredity, vol. 94, pp. 465-477, 2005.
- U. Schmidt-Ott, M. Gonzalez-Gaitan, H. Jackle, and G. M. Technau, "Number, identity, and sequence of the Drosophila head segments as revealed by neural elements and their deletion patterns in mutants," Proc Natl Acad Sci U S A, vol. 91, pp. 8363-7, Aug 30 1994.
- S. M. Cohen and G. Jurgens, "Mediation of Drosophila head development by gap-like segmentation genes," Nature, vol. 346, pp. 482-5, Aug 2 1990.
- R. Urbach and G. M. Technau, "Early steps in building the insect brain: neuroblast formation and segmental patterning in the developing brain of different insect species," Arthropod structure & development, vol. 32, pp. 103-123, 2003.
- M. D. Cleary and C. Q. Doe, "Regulation of neuroblast competence: multiple temporal identity factors specify distinct neuronal fates within a single early competence window," Genes Dev, vol. 20, pp. 429-34, Feb 15 2006.
- T. Brody and W. F. Odenwald, "Programmed transformations in neuroblast gene expression during Drosophila CNS lineage development," Developmental Biology, vol. 226, pp. 34-44, 2000.
- D. Duboule and G. Morata, "Colinearity and functional hierarchy among genes of the homeotic complexes," Trends Genet, vol. 10, pp. 358-64, Oct 1994.
- R. S. Mann, "Why are Hox genes clustered?," Bioessays, vol. 19, pp. 661-4, Aug 1997.
- J. B. Skeath and S. Thor, "Genetic control of Drosophila nerve cord development," Curr Opin Neurobiol, vol. 13, pp. 8-15, Feb 2003.
- O. Birkholz, C. Rickert, J. Nowak, I. C. Coban, and G. M. Technau, "Bridging the gap between postembryonic cell lineages and identified embryonic neuroblasts in the ventral nerve cord of Drosophila melanogaster," Biol Open, vol. 4, pp. 420-34, 2015.
- H. Reichert and B. Bello, "Hox Genes and Brain Development in Drosophila," in Hox Genes. vol. 689, J. Deutsch, Ed., ed: Springer New York, 2010, pp. 145-153.
- P. A. Kuert, B. C. Bello, and H. Reichert, "The labial gene is required to terminate proliferation of identified neuroblasts in postembryonic development of the Drosophila brain," Biology open, vol. 1, pp. 1006-1015, 2012.
- R. Albertson, C. Chabu, A. Sheehan, and C. Q. Doe, "Scribble protein domain mapping reveals a multistep localization mechanism and domains necessary for establishing cortical polarity," J Cell Sci, vol. 117, pp. 6061-70, Dec 1 2004.
- A. J. Ebens, H. Garren, B. N. R. Cheyette, and S. L. Zipursky, "The Drosophila anachronism locus: A glycoprotein secreted by glia inhibits neuroblast proliferation," Cell, vol. 74, pp. 15-27, 1993.
- S. Therianos, S. Leuzinger, F. Hirth, C. S. Goodman, and H. Reichert, "Embryonic development of the Drosophila brain: formation of commissural and descending pathways," Development, vol. 121, pp. 3849-60, Nov 1995.
- C. Maurange and A. P. Gould, "Brainy but not too brainy: starting and stopping neuroblast divisions in Drosophila," Trends Neurosci, vol. 28, pp. 30-6, Jan 2005.
- B. C. Bello, F. Hirth, and A. P. Gould, "A pulse of the Drosophila Hox protein Abdominal-A schedules the end of neural proliferation via neuroblast apoptosis," Neuron, vol. 37, pp. 209-219, 2003.
- W. Yeo and J. Gautier, "Early neural cell death: dying to become neurons," Developmental Biology, vol. 274, pp. 233-244, 2004.
- L. Krubitzer, "In search of a unifying theory of complex brain evolution," Annals of the New York Academy of Sciences, vol. 1156, pp. 44-67, 2009.
- D. Arendt, A. S. Denes, G. Jékely, and K. Tessmar-Raible, "The evolution of nervous system centralization," Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 363, pp. 1523-1528, 2008.
- S. Harzsch, "Ontogeny of the ventral nerve cord in malacostracan crustaceans: a common plan for neuronal development in Crustacea, Hexapoda and other Arthropoda?," Arthropod structure & development, vol. 32, pp. 17-37, 2003.
- A. Stollewerk and P. Simpson, "Evolution of early development of the nervous system: a comparison between arthropods," Bioessays, vol. 27, pp. 874-883, 2005.
- L. Z. Holland, J. E. Carvalho, H. Escriva, V. Laudet, M. Schubert, S. M. Shimeld, et al., "Evolution of bilaterian central nervous systems: a single origin," EvoDevo, vol. 4, p. 27, 2013.
- H. Reichert, "A tripartite organization of the urbilaterian brain: developmental genetic evidence from Drosophila," Brain Res Bull, vol. 66, pp. 491-4, Sep 15 2005.
- F. Hirth, L. Kammermeier, E. Frei, U. Walldorf, M. Noll, and H. Reichert, "An urbilaterian origin of the tripartite brain: developmental genetic insights from Drosophila," Development, vol. 130, pp. 2365-73, Jun 2003.
- F. Inoue, D. Kurokawa, M. Takahashi, and S. Aizawa, "Gbx2 directly restricts Otx2 expression to forebrain and midbrain, competing with class III POU factors," Mol Cell Biol, vol. 32, pp. 2618-27, Jul 2012.
- A. W. Puschel, M. Westerfield, and G. R. Dressler, "Comparative analysis of Pax-2 protein distributions during neurulation in mice and zebrafish," Mech Dev, vol. 38, pp. 197-208, Sep 1992.
- A. H. Brand and F. J. Livesey, "Neural stem cell biology in vertebrates and invertebrates: more alike than different?," Neuron, vol. 70, pp. 719-729, 2011.
- B. Egger, J. M. Chell, and A. H. Brand, "Insights into neural stem cell biology from flies," Philos Trans R Soc Lond B Biol Sci, vol. 363, pp. 39-56, Jan 12 2008.
- N. Agrawal, J. Pallos, N. Slepko, B. L. Apostol, L. Bodai, L. W. Chang, et al., "Identification of combinatorial drug regimens for treatment of Huntington's disease using Drosophila," Proc Natl Acad Sci U S A, vol. 102, pp. 3777-81, Mar 8 2005.
- M. B. Feany and W. W. Bender, "A Drosophila model of Parkinson's disease," Nature, vol. 404, pp. 394-8, Mar 23 2000.
- N. M. Bonini and M. E. Fortini, "Human neurodegenerative disease modeling using Drosophila," Annu Rev Neurosci, vol. 26, pp. 627-56, 2003.
- M. J. Palladino, T. J. Hadley, and B. Ganetzky, "Temperature-sensitive paralytic mutants are enriched for those causing neurodegeneration in Drosophila," Genetics, vol. 161, pp. 1197-208, Jul 2002.
- M. Jaiswal, H. Sandoval, K. Zhang, V. Bayat, and H. Bellen, "Probing mechanisms that underlie human neurodegenerative diseases in Drosophila," Annual review of genetics, vol. 46, p. 371, 2012.
- T. Isshiki, M. Takeichi, and A. Nose, "The role of the msh homeobox gene during Drosophila neurogenesis: Implication for the dorsoventral specification of the neuroectoderm," Development, vol. 124, pp. 3099-3109, 1997.
- G. Schlosser, C. Patthey, and S. M. Shimeld, "The evolutionary history of vertebrate cranial placodes II. Evolution of ectodermal patterning," Developmental Biology, vol. 389, pp. 98-119, 2008.
- J. Bond, E. Roberts, K. Springell, S. Lizarraga, S. Scott, J. Higgins, et al., "A centrosomal mechanism involving CDK5RAP2 and CENPJ controls brain size," Nat Genet, vol. 37, pp. 353-355, 04//print 2005.
- I. G. Macara and S. Mili, "Polarity and differential inheritance—universal attributes of life?," Cell, vol. 135, pp. 801-812, 2008.
- D. C. Diaper and F. Hirth, "Immunostaining of the Developing Embryonic and Larval Drosophila Brain," in Brain Development, ed: Springer, 2014, pp. 3-17.
- K. White and D. R. Kankel, "Patterns of cell division and cell movement in the formation of the imaginal nervous system in Drosophila melanogaster," Developmental Biology, vol. 65, pp. 296-321, 8// 1978.
- U. Hanesch, K. F. Fischbach, and M. Heisenberg, "Neuronal architecture of the central complex in Drosophila melanogaster," Cell and Tissue Research, vol. 257, pp. 343-366, 1989.
- K. Ito and Y. Hotta, "Proliferation pattern of postembryonic neuroblasts in the brain of Drosophila melanogaster," Developmental Biology, vol. 149, pp. 134-148, 1992.
- B. D. Pfeiffer, A. Jenett, A. S. Hammonds, T.-T. B. Ngo, S. Misra, C. Murphy, et al., "Tools for neuroanatomy and neurogenetics in Drosophila," Proceedings of the National Academy of Sciences, vol. 105, pp. 9715-9720, 2008.
- B. D. Pfeiffer, T.-T. B. Ngo, K. L. Hibbard, C. Murphy, A. Jenett, J. W. Truman, et al., "Refinement of tools for targeted gene expression in Drosophila," Genetics, vol. 186, pp. 735-755, 2010.
- K. J. Venken, J. H. Simpson, and H. J. Bellen, "Genetic manipulation of genes and cells in the nervous system of the fruit fly," Neuron, vol. 72, pp. 202-230, 2011.
- T. Dobzhansky, "Nothing in biology makes sense, except in the light of evolution," in The Epistemology of Development, Evolution, andGenetics, R. Burian, Ed., ed: Cambridge Studies in Philosophy and Biology, 2004.
Evrim Ağacı'nda tek bir hedefimiz var: Bilimsel gerçekleri en doğru, tarafsız ve kolay anlaşılır şekilde Türkiye'ye ulaştırmak. Ancak tahmin edebileceğiniz gibi Türkiye'de bilim anlatmak hiç kolay bir iş değil; hele ki bir yandan ekonomik bir hayatta kalma mücadelesi verirken...
O nedenle sizin desteklerinize ihtiyacımız var. Eğer yazılarımızı okuyanların %1'i bize bütçesinin elverdiği kadar destek olmayı seçseydi, bir daha tek bir reklam göstermeden Evrim Ağacı'nın bütün bilim iletişimi faaliyetlerini sürdürebilirdik. Bir düşünün: sadece %1'i...
O %1'i inşa etmemize yardım eder misiniz? Evrim Ağacı Premium üyesi olarak, ekibimizin size ve Türkiye'ye bilimi daha etkili ve profesyonel bir şekilde ulaştırmamızı mümkün kılmış olacaksınız. Ayrıca size olan minnetimizin bir ifadesi olarak, çok sayıda ayrıcalığa erişim sağlayacaksınız.
Makalelerimizin bilimsel gerçekleri doğru bir şekilde yansıtması için en üst düzey çabayı gösteriyoruz. Gözünüze doğru gelmeyen bir şey varsa, mümkünse güvenilir kaynaklarınızla birlikte bize ulaşın!
Bu makalemizle ilgili merak ettiğin bir şey mi var? Buraya tıklayarak sorabilirsin.
Soru & Cevap Platformuna Git- 3
- 1
- 1
- 1
- 1
- 1
- 0
- 0
- 0
- 0
- 0
- 0
Evrim Ağacı'na her ay sadece 1 kahve ısmarlayarak destek olmak ister misiniz?
Şu iki siteden birini kullanarak şimdi destek olabilirsiniz:
kreosus.com/evrimagaci | patreon.com/evrimagaci
Çıktı Bilgisi: Bu sayfa, Evrim Ağacı yazdırma aracı kullanılarak 01/03/2026 14:23:31 tarihinde oluşturulmuştur. Evrim Ağacı'ndaki içeriklerin tamamı, birden fazla editör tarafından, durmaksızın elden geçirilmekte, güncellenmekte ve geliştirilmektedir. Dolayısıyla bu çıktının alındığı tarihten sonra yapılan güncellemeleri görmek ve bu içeriğin en güncel halini okumak için lütfen şu adrese gidiniz: https://evrimagaci.org/s/414
İçerik Kullanım İzinleri: Evrim Ağacı'ndaki yazılı içerikler orijinallerine hiçbir şekilde dokunulmadığı müddetçe izin alınmaksızın paylaşılabilir, kopyalanabilir, yapıştırılabilir, çoğaltılabilir, basılabilir, dağıtılabilir, yayılabilir, alıntılanabilir. Ancak bu içeriklerin hiçbiri izin alınmaksızın değiştirilemez ve değiştirilmiş halleri Evrim Ağacı'na aitmiş gibi sunulamaz. Benzer şekilde, içeriklerin hiçbiri, söz konusu içeriğin açıkça belirtilmiş yazarlarından ve Evrim Ağacı'ndan başkasına aitmiş gibi sunulamaz. Bu sayfa izin alınmaksızın düzenlenemez, Evrim Ağacı logosu, yazar/editör bilgileri ve içeriğin diğer kısımları izin alınmaksızın değiştirilemez veya kaldırılamaz.

/evrimagaci.org/public/images/logo-50.png)